
|
Читайте также: |
1. 2 B (OH)n → B 2On  ;
;
M B = 18,6n; при n = 3 M B = 55,8 г/моль; B – Fe.
Метал А – це Cr (забарвлення розчинів у різних середовищах). Тоді ізоморфні аніони FeO42– та CrO42–; у жовтому розчині CrO42– (X 2–), в оранжевому Cr2O72– (X 22–), у червоному Cr3O102– та Cr4O132–.
При титруванні на катоді: Cr2O72– + 14 H+ + 6e– = 2 Cr3+ + 7 H2O
та Cu2+ + e– = Cu+.
В об’ємі розчину: Cr2O72– + 14 H+ + 6 Cu+ = 2 Cr3+ + 6 Cu2+ + 7 H2O.
 (моль).
(моль).
В 200 мл: νCr = 4,69∙10–5 ∙ 4 = 1,88∙10–4 (моль);  (моль/л);
(моль/л);
 (моль).
(моль).
 . Шпінель – FeCr2O4.
. Шпінель – FeCr2O4.
При підготовці зразку: FeCr2O4 + 6 KO2 = K2FeO4 + 2 K2CrO4 + 2 O2;
4 K2FeO4 + 10 H2O = 4 Fe(OH)3↓ + 3 O2 + 8 KOH;
3 K2CrO4 + 2 H2SO4 = K2Cr3O10 + 2 K2SO4 + 2 H2O;
4 K2CrO4 + 3 H2SO4 = K2Cr4O13 + 3 K2SO4 + 3 H2O;
2 Cr3O102– + 2 OH– = 3 Cr2O72– + H2O;
Cr4O132– + 2 OH– = 2 Cr2O72– + H2O.
2.  ;
;  .
.
| 3. | 
| 
| |
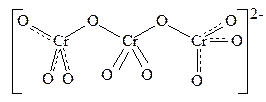
| 
| ||
4. pH = 7; [H+] = 10–7 (моль/л).
HCrO4– = H+ + CrO42–  ;
;
2 HCrO4– = Cr2O72– + H2O  ;
;
матеріальний баланс: C = [HCrO4–] + [CrO42–] + 2 ∙ [Cr2O72–] = 9,4∙10–4.
 ;
;
75,6 ∙ [HCrO4–]2 + 4,2 ∙ [HCrO4–] – 9,4∙10–4 = 0;
[HCrO4–] = 2,23∙10–4; [Cr2O72–] = 1,88∙10–6; [CrO42–] = 7,14∙10–4 (моль/л).
КЛАСИЧНІ УНІВЕРСИТЕТИ
Розв’язок 5.
| 1. | 2 CO2 | ⇆ | 2 CO | + | O2 |  .
З рівняння Ван’т-Гоффа: .
З рівняння Ван’т-Гоффа:
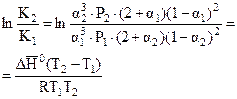
|
| ν; вих. | ||||||
| Δ | α | α | α/2 | |||
| рівн. | 1 – α | α | α/2 | |||
| χі ∙ Р | 
| 
| 
|
 ;
;  (Дж).
(Дж).
2. Δа = 0; Δb = –6,49∙10–3; Δc = 12,37∙105.
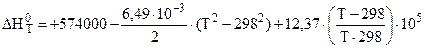 ;
;
 (Дж);
(Дж);  (Дж).
(Дж).
 .
.
3. (2 + α) ∙ (1 – α)2 = α3; 3 ∙ α = 2; α = 0,667 (66,7 %).
χ(CO2) = 0,25 (25 %); χ(CO) = 0,50 (50 %); χ(O2) = 0,25 (25 %).
| 4. | 2 CO | + | O2 | ⇆ | 2 CO2 | ΔG = RT(lnП – lnK)
V ↑ C ↓ 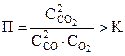 ; ;
| ΔG > 0 ← |
| V ↑ | < | < | < | ||||
| ← | > | > | < | ||||
| < | < | < |
КЛАСИЧНІ УНІВЕРСИТЕТИ
Дата добавления: 2015-09-06; просмотров: 89 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЗАВДАННЯ | | | Человек без возраста |