
Читайте также:
|
Количественное квантово-механическое решение проблемы химической связи для одноэлектронной молекулярной системы привело к определению связывающих и разрыхляющих МО. С учетом этих принципиальных понятий орбитальное приближение распространяется на многоэлектронные молекулярные системы по аналогии с атомными.
Электронные конфигурации следующих за Н2+ простейших молекулярных систем, образованных в результате заполнения орбиталей электронами в соответствии с принципом наименьшей энергии и принципом запрета Паули представлены на рис. 2.4. При этом диамагнетизм молекулы Н2 находит естественное объяснение, поскольку суммарный спин ее двух спаренных электронов равен 0, а отсутствие в природе молекулы из двух атомов Не объясняется энергетической невозможностью их связанного состояния по выше приведенному следствию 2.
Второй из определителей (2.9) фактически определяет способ построения орбитальной модели для более сложных, многоэлектронных систем из большего числа орбиталей, необходимых для размещения многих электронов. Привлечение 1 s -, 2 s -, 2 px -, 2 py -, 2 pz - водородных орбиталей дает возможность для двухатомных молекул организовать систему из 10 МО, которые классифицируются по симметрии и энергии.
При наличии естественной оси симметрии (для определенности ось z) для линейных молекул, их молекулярные орбитали характеризуются квантовым числом λ, аналогичным квантовому числу ml, которое определяет величину проекции орбитального момента электрона на молекулярную ось. Для σ-орбитали λ=0. Орбитали с λ = 1, 2, 3… по аналогии называются π, δ, φ, ….Последние дважды вырождены. Их проекция на ось молекулы равна ± λ ħ.
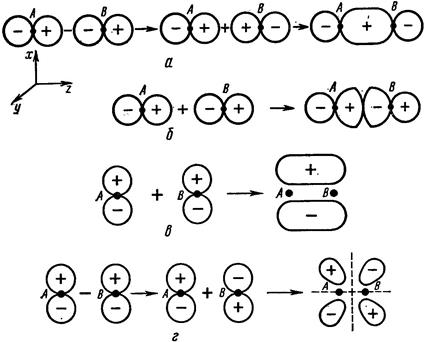
| Рис. 2.6 вслед за рис. 2.5 продолжает схематичное изображение процесса образования σ, π - связывающих и разрыхляющих (*) орбиталей из p -орбиталей атомов А и В. |
| Рис. 2.6.Образование σ - (а, б) и π- (в,г)МО из р- АО атомов А и В. |
Квантово-химические расчеты совместно с данными молекулярной спектроскопии дают следующий порядок энергий МО для молекул, построенных из атомов 1-го и 2-го периодов.
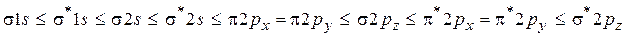
Для получения электронной конфигурации двухатомной молекулы необходимо разместить соответствующие числа электронов на МО с учетом принципа Паули и правила Гунда (рис. 2.7):
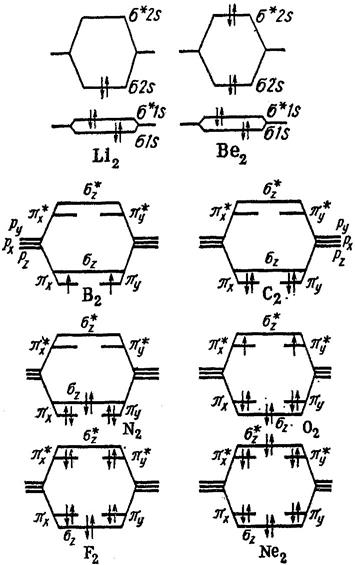
| - Молекула Li2 диамагнитна, поскольку спины электронов спарены.
- Молекула Be2 экспериментально не обнаружена, что объяснимо отсутствием необходимого для образования химической связи избытка связывающих электронов.
- Избыток в шесть связывающих электронов в молекуле N2 соответствует представлению о прочной тройной связи.
- Следующие два электрона, заполняющие МО в молекуле О2 размещаются по одному на каждой из вырожденных  π*2 рx = π*2 рx =  π*2 рy орбиталей согласно правилу Гунда.
Парамагнетизм молекулы-бирадикала О2 как следствие двух неспаренных электронов получил объяснение только в теории МО. π*2 рy орбиталей согласно правилу Гунда.
Парамагнетизм молекулы-бирадикала О2 как следствие двух неспаренных электронов получил объяснение только в теории МО.
|
| Рис. 2.7. Электронные конфигурации гомоядерных молекул. |
Результаты квантово-химических расчетов разнообразных молекулярных систем представляются в виде орбитально-энергетических диаграмм. (Рис. 2.8., Рис. 2.9.)
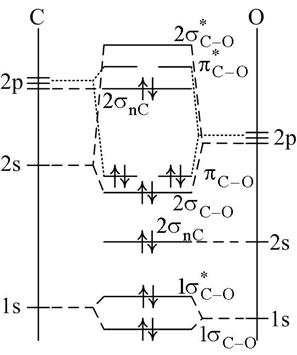
Несвязывающие орбитали отмечаются индексом n. Самую верхнюю из таких в молекуле СО (рис. 2.8) занимает неподелённая пара, в данном случае принадлежащая углероду. Вместе с незанятыми, в том числе, разрыхляющими орбиталями они играют важную роль в химических реакциях и процессах комплексообразования.
| 
|
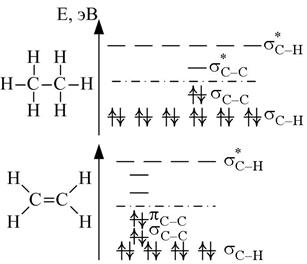
| Рис. 2.8. Орбитально-энергетическая диаграмма образования МО молекулы СО. | Рис. 2.9. Распределение электронов по орбиталям в молекулах этана и этилена. |
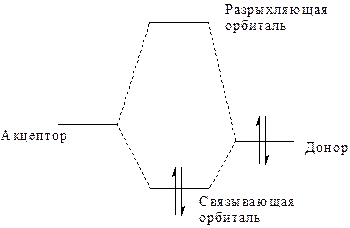
| Перекрывание низкоэнергетической незанятой d* Fe-орбитали железа (акцептора электронов) с σ n C - несвязывающей орбиталью СО (донора электронной пары) приводит к образованию донорно-акцепторной связи в пентакарбониле железа (Fe(CO)5). По аналогичной схеме в этом соединении образуются МО из орбиталей d Fe и π*С-О. |
Донорно-акцепторная связь по своей природе является ковалентной связью с той или иной степенью полярности.
Основы электронного строения кристаллов можно понять, если рассмотреть схему изменения энергетических подуровней валентной электронной оболочки изолированных атомов, конденсирующихся в твердую фазу. (Рис. 1.3. соответствует металлическому литию).
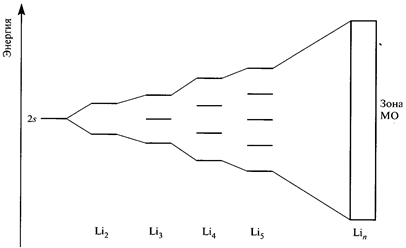 Рис. 1.3. Перекрывание двух 2s атомных орбиталей (АО) в молекуле Li2 приводит к образованию двух молекулярных орбиталей (МО). В случае трёх атомов лития образуются три МО и т.д. В Li n образуется n очень близких по энергиям МО, которые можно рассматривать как зону. Каждый атом имеет один валентный электрон, и зона оказывается полузаполненной.
Рис. 1.3. Перекрывание двух 2s атомных орбиталей (АО) в молекуле Li2 приводит к образованию двух молекулярных орбиталей (МО). В случае трёх атомов лития образуются три МО и т.д. В Li n образуется n очень близких по энергиям МО, которые можно рассматривать как зону. Каждый атом имеет один валентный электрон, и зона оказывается полузаполненной.
| 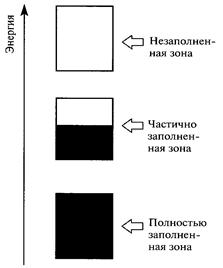 Рис. 1.4. Характерной чертой металла является наличие частично заполненной зоны. Исходные выше- и нижележащие АО образуют соответственно незаполненные и полностью заполненные зоны.
Рис. 1.4. Характерной чертой металла является наличие частично заполненной зоны. Исходные выше- и нижележащие АО образуют соответственно незаполненные и полностью заполненные зоны.
|
Между указанными на рис. 1.4 зонами могут располагаться достаточно большие запрещенные участки или зоны. В случае близких исходных АО зоны МО могут и перекрываться с образованием единой зоны смешанного типа.
Следует подчеркнуть, что энергетические зоны принадлежат кристаллу как единое целое и не относятся к его отдельным атомам, т.е. связывающие электроны в металле делокализованы и металлическая связь является ненаправленной.
Вся совокупность валентных электронов кристалла, располагающаяся на верхних заполненных подуровнях образует его валентную зону. При 0 К электроны Li занимали бы только половину самых низких уровней зоны. Зона проводимости образуется из незанятых электронами вышележащих энергетических подуровней атомов. В металлах при обычных температурах за счет тепловой энергии валентные электроны распределяются не только по валентной зоне, но и по нижним уровням зоны проводимости. Под действием внешнего напряжения электроны перескакивают на более высокие уровни в пределах этой зоны, что соответствует практически свободному перемещению электрических зарядов через весь кристалл. У ионных и ковалентных веществ валентные зоны полностью заполнены электронами, поскольку у исходных молекул или ионов все валентные орбитали заполнены электронами.
| Высокоуровневая зона проводимости в ионных и ковалентных кристаллах оказывается пустой, даже при действии высокого напряжения, вследствие наличия большойзапрещенной зоны, которая соответствует отсутствию коллективизированных уровней между зоной проводимости и полностью заполненной валентной зоной. Разумеется, при очень высоких температурах или чрезвычайно больших напряжениях может наступить пробой такого изолятора, подобно тому, как это бывает при проскакивании искр в воздухе. Зонная структура электронных энергетических уровней в полупроводниках имеет промежуточный характер между описанными выше для проводников (металлов) и изоляторов (ионных и ковалентных твердых веществ). При повышении температуры электроны получают возможность перескакивать через запрещенную зону и оказываются в зоне проводимости. | 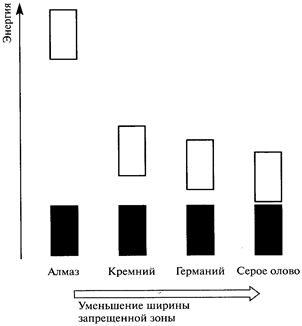 Рис. 1.4'. Зонная структура энергетических уровней электронов в изоляторах и полупроводниках.
Рис. 1.4'. Зонная структура энергетических уровней электронов в изоляторах и полупроводниках.
|
При этом электропроводность быстро увеличивается в результате возрастания заселенности зоны проводимости и одновременного образования вакансий, или «дырок», в валентной зоне. Переход электронов в зону проводимости может осуществляться в результате поглощения света (явление фотопроводимости).
Электропроводность металлов, хотя и менее значительно, но уменьшается с ростом температуры вследствие возрастающих при повышении температуры колебаниях кристаллической решетки, которые препятствуют продвижению электронов.
Зонная модель объясняет присущий всем металлам специфический блеск. Наличие большого числа чрезвычайно близких энергетических уровней приводит к тому, что свет, падающий на металлический кристалл, практически полностью отражается им вследствие последовательных актов поглощения – испускания световых квантов. При облучении металла светом с достаточно большой энергией (частотой) электроны могут полностью отрываться от его поверхности. Это явление получило название внешнего фотоэлектрического эффекта.
Низкотемпературная сверхпроводимость возникает как результат образования куперовских пар при электрон-колебательных взаимодействиях в кристаллах (мощные электромагниты, передача энергии, транспортные проблемы…).
Дата добавления: 2015-09-02; просмотров: 103 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химическая связь | | | Глава вторая. Одинокий и оскорбленный. |