
Читайте также:
|
11.3.3.1. Переносчики электронов
Переносчики электронов размещены на поверхности или в глубине внутренней митохондриальной мембраны, которая уложена в кресты, число и плотность упаковки которых кооррелируют с энергетическими потребностями клетки.
Многие переносчики электронов – это белки, содержащие в качестве простетической группы гем.

Свойства молекулы гема зависят от белка, к которому он присоединен. Кроме того, гемы в разных цитохромах могут отличаться строением боковых групп и способом прикрепления к апобелку. Поэтому цитохромы могут отличаться редокс-потенциалами, хотя у них у всех простетические группы почти одинаковы.
Переносчики электронов называются цитохромами, так как они окрашены в красный цвет. Разные цитохромы обозначаются буквенными индексами: с1, с, а, а3 – в порядке их расположения в цепи.
К другому типу негемовых железосодержащих переносчиков электронов относятся белки, в которых атомы железа связаны с сульфгидрильными группами остатков цистеина белка, а также с сульфгидрильными анионами остатков, образуя железо-серные комплексы, или центры (рис. 29).
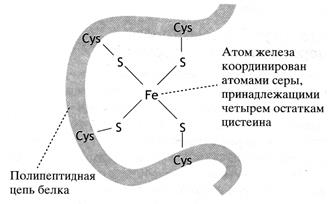
Рис. 29. Строение железо-серного центра
Как и в цитохромах, атомы железа в таких центрах могут принимать и отдавать электроны, поочередно переходя в ферро(Fe2+)- и ферри(Fe3+)-состояния. Железо-серные центры функционируют совместно с флавинсодержащими ферментами, принимая электроны от сукцинатдегидрогеназы и дегидрогеназ, участвующих в окислении жиров.
Еще одним типом переносчиков является ФМН-содержащий белок. ФМН (флавинаденин-мононуклеотид) – соединение, которое представляет собой флавиновую половину молекулы ФАД. ФМН переносит электроны от ФАДН на железо-серные центры.
Все белковые переносчики – интегральные белки, занимающие в мембране строго фиксированное положение и ориентированные определенным образом. Исключение составляет цитохром с, который непрочно связан с внешней мембраной и легко покидает ее.

Единственный небелковый переносчик электронов – убихинон, названный так потому, что, с одной стороны, он – хинон, а с другой – встречается повсеместно (от англ. ubiquitious – вездесущий). Сокращенное его название CoQ, UQ или просто Q. Все железо-серные центры отдают электроны убихинону.
Убихинон при восстановлении приобретает не только электроны, но и протоны (рис. 30).

Рис.30. Убихинон – кофермент Q (а)
и его окислительно-восстановительные превращения (б)
При одноэлектронном восстановлении он превращается в семихинон (органически свободный радикал), а при двухэлекторонном – в гидрохинон. Именно промежуточное образование свободного радикала позволяет убихинону служить переносчиком не двух, а одного электрона. Очень длинный гидрофобный хвост (40 углеродных атомов в десяти последовательно соединенных изопреноидных остатках) придает убихинону способность легко внедряться и свободно перемещаться в неполярном слое внутренней митохондриальной мембраны.
11.3.3.2. Расположение переносчиков
Поток электронов между переносчиками направлен от переносчика с более высоким восстановительным потенциалом (т.е. меньшим редокс-потенциалом) к переносчику с более низким восстановительным потенциалом (т.е. более окисленному, с большим редокс-потенциалом) (рис. 31).

Рис.31. Редокс-потенциалы компонентов дыхательной цепи в митохондриях
В митохондриальной цепи переносчики обладают разными редокс-потенциалами.
Переносчики электронов в цепи расположены в цепи так, что DG0 (свободная энергия) постепенно уменьшается, а редокс-потенциал, соответственно, возрастает. На каждом этапе передачи электрона соседнему по цепи переносчику высвобождается свободная энергия.
При окислении глюкозы происходит перенос электронов от НАДН и ФАДН2 на кислород. В этом процессе участвуют много переносчиков, однако их можно сгруппировать в четыре комплекса, которые встроены в митохондриальную мембрану
(рис. 32).

Рис. 32. Четыре комплекса электронных переносчиков
в митохондриальной мембране
Между комплексами электроны перемещаются вместе с подвижными переносчиками: убихиноном и цитохромом с. Убихинон получает электроны от комплексов I и II и передает их комплексу III. Цитохром с служит посредником между комплексами III и IV. Комплекс I переносит электроны от НАДН на Q; комплекс II – от сукцината через ФАДН2 на Q; комплекс III использует QH2 для восстановления цитохрома с, а комплекс IV передает электроны с цитохрома с на кислород. Комплексы I, III и IV называют соответственно НАДН-СоQ-редуктазой, СоQН2-цитохром с -редуктазой и цитохромоксидазой. Комплекс IV – цитохромоксидаза – состоит из нескольких белков. Он получает электроны от цитохрома с с внешней стороны внутренней митохондриальной мембраны. На пути к кислороду эти электроны проходят через цитохромы а и а3, содержащие атомы меди, которые поочередно переходят в состояния Cu+ и Cu2+. Цитохромоксидаза осуществляет восстановление свободного кислорода:
О2 + 4 е- + 4Н+ ® 2Н2О
11.3.3.3. Хемиосмотическая теория Митчелла
Транспорт электронов по дыхательной цепи приводит к генерации АТФ. Концепция механизма сопряжения транспорта электронов с синтезом АТФ была разработана английским биохимиком Питером Митчеллом в 1961 г. (в 1978 г. Митчеллу была присуждена Нобелевская премия). Митчелл обнаружил, что поток электронов вызывает выкачивание протонов из митохондрий в окружающую среду, создавая градиент протонов через мембрану (рН внешнего раствора уменьшается). Поскольку протоны являются положительно заряженными частицами, вследствие их выкачивания из митохондрий на мембране возникает разность электрического потенциала (минус - внутри) и разность рН (выше – внутри). В совокупности электрический и концентрационный градиенты составляют (по Митчеллу) протондвижущую силу, которая и является источником энергии для синтеза АТФ (рис. 33).


Рис. 33. Схема синтеза АТФ во внутренней
митохондриальной мембране
Протондвижущая сила приводит в действие АТФ-синтазные комплексы, использующие поток электронов для синтеза АТФ из АДФ и Ф. Комплексы представляют собой специализированные протонные каналы (грибовидные выросты, которыми покрыта внутренняя поверхность крист). Комплекс представлен двумя связанными между собой компонентами F0 F1, каждый из которых состоит из нескольких белковых молекул. F0 утоплен в мембране, а F1 расположен на ее поверхности. Именно в F1 синтезируется АТФ, тогда как F0 выполняет функцию собственно протонного канала (рис. 34).

Рис 34. Схематическое изображение «грибовидной» структуры F0F1АТФ – синтетазы Е.coli. F0 компонент пронизывает мембрану, образуя канал для протонов. Предполагается, что F1 состоит из трех a и трех b субъединиц, организованных так, что они образуют гексамерную структуру наподобие «шляпки гриба», и одной g, одной d и одной e субъединиц, которые формируют «стержень», соединяющий F0 с F1 каналом
Неизвестно точно, как возникает АТФ при посредстве АТФ-синтетазы. Согласно одной из теорий, при транслокации протонов по F0-фактору, происходят конформационные изменения в F1-компоненте, который и синтезирует АТФ из АДФ и Ф.
Каждой паре электронов, перенесенных от НАДН на кислород, соответствует 10 протонов, перекаченных из митохондриального матрикса. Таким образом, окисление 1 молекулы НАДН приводит к синтезу 2,5 молекул АТФ, а окисление 1 молекулы ФАДН2 – к синтезу 1,5 молекулы АТФ. Раньше полагали, что синтезируются соответственно, три и две молекулы АТФ. Эти величины принято называть отношениями Р/О, поскольку перенос 2 электронов эквивалентен восстановлению 1 атома кислорода.
Выход АТФ при окислении молекулы глюкозы до СО2 и Н2О.
При гликолизе образуется 2 молекулы АТФ (продуцируется 4, но 2 расходуются). При гликолизе в цитоплазме образуется также 2 молекулы НАДН на 1 молекулу глюкозы. 2 молекулы АТФ образуются в цикле лимонной кислоты (из 1 молекулы глюкозы образуется 2 молекулы ацетил-КоА, запускающие два оборота цикла).
В расчете на 1 молекулу глюкозы пируватдегидрогеназа производит 2 молекулы НАДН, а цикл лимонной кислоты – 6 молекул НАДН. Их окисление приводит к синтезу 20 молекул АТФ. Еще три молекулы АТФ образуется за счет окисления ФАДН2 при превращении сукцината в фумарат.
Суммарный выход молекул АТФ будет зависет от того, какой челночного механизм (глицерофосфатный и малатаспартатный) используется клетками для доставки НАДН к дыхательной цепи. При глицеролфосфатном механизме электроны от НАДН передаются на дигидрооксиацетонфосфат с образованием глицерол-3-фосфата, который переносит электроны на дыхательную цепь (рис.35). Это происходит при участии фермента глицерол-3-фосфатдегидрогеназы. В помошью цитоплазматического НАДН происходит восстановление митохондриального ФАД, являющегося простетической группой флавопротеина - глицерол-3-фосфатдегидрогеназы.

Рис. 35. Глицеролфосфатный челночный механизм
Другая челночная система - малат-аспартатная - переносит электроны от цитоплазматического НАДН к митохондриальному НАД+ (рис. 36). Это приводит к образованию митохондриального НАДН, который далее окисляется в электроннотранспортной цепи. В цитоплазме НАДН восстанавливает оксалоацетат до малата. Последний с помощью переносчика попадает в митоходрии, где реокисляется в оксалоацетат с восстановлением НАД+. Сам оксалоацетат выйти из митохондрий не может, поэтому он сначала превращается в аспартат, который и транспортируется переносчиком в цитоплазму. В цитоплазме аспартат дезаминируется, превращаясь в оксалоацетат и замыкая тем самым челночный механизм.

Рис.36. Малат-аспартатная челночная система для переноса электронов
Глюконеогенез
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Организм может синтезировать глюкозу соединений, способных предварительно превратиться в пируват, т.е. из большинства аминокислот и лактата, поступающих в кровь из работающих мышц. Глюкоза не может быть синтезирована из ацетил-КоА и жирных кислот.
Наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе). Глюконеогенез позволяет сохранить энергию превращений в виде гликогена, а также способствует поддержанию уровня глюкозы в крови в пределах нормы при голодании (что особенно важно для нормальной работы мозга), в период интенсивной физической работы.
Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только три реакции гликолиза (гексокиназная, фосфофруктокиназная и пируваткиназная) необратимы, поэтому в процесс глюконеогенеза на 3-х этапах используются другие ферменты (рис.37).

Рис. 37. Гликолиз и глюконеогенез
Образование фосфоенолпирувата из пирувата. Синтез фосфоенолпирувата осуществляется в несколько этапов. Сначала пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):

Первый этап синтеза протекает в митохондриях. Пируваткарбоксилаза, катализирующая эту реакцию, является аллостерическим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата. Последний здесь же, в митохондриях, восстанавливается в малат:

Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. Оксалоацетат восстанавливается в малат, который легко выходит из митохондрий через митохондриальную мембрану. В цитозоле отношение НАДН/НАД+ очень мало, и малат вновь окисляется при участии цитоплазматической НАД-зависимой малатдегидрогеназы:

Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитозоле клетки.
Превращение фруктозо-1,6-бифосфата в фруктозо-6-фосфат. Фосфоенолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бифосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой реакции. Превращение фруктозо-1,6-бифосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:
Фруктозо-1,6-бифосфат + НО2 ® Фруктозо-6-фосфат + Рi
Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:
Глюкозо-1,6-фосфат + НО2 ® Глюкоза + Рi
Регуляция глюконеогенеза. Важным моментом в регуляции глюконеогенеза является пируваткарбоксилазная реакция. В отсутствии ацетил-КоА, выполняющего функцию аллостерического активатора пируваткарбоксилазы, фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Одновременно ацетил-КоА является ингибитором пируватдегидрогеназного комплекса. Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу.
Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бифосфотазой – ферментом, который ингибируется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т.е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы.
Мощным регулятором активности фосфофруктокиназы и фруктозо-1,6-бифосфатазы является фруктозо-2,6-бифосфат. Фруктозо-2,6-бифосфат активирует фосфофруктокиназы и ингибирует фруктозо-1,6-бифосфатазу. Повышение в клетке уровня фруктозо-2,6-бифосфата способствует усилению гликолиза и уменьшению скорости глюконеогенеза. При снижении концентрации фруктозо-2,6-бифосфата отмечается обратная картина.
Дата добавления: 2015-10-23; просмотров: 271 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Окисление глюкозы | | | Пентозофосфатный путь окисления глюкозы |