
Читайте также:
|
1. Строение и значение соед ткани
Соединительная ткань составляет до 50 % массы человеческого организма. Это связующее звено
между всеми тканями организма.
Различают 3 вида соединительной ткани: собственно соединительная ткань; хрящевая соединительная ткань;
костная соединительная ткань.
Соединительная ткань может выполнять как самостоятельные функции, так и входить в качестве
прослоек в другие ткани. Функции соединительной ткани: структурная, обеспечение постоянства тканевой проницаемости, Обеспечение водно-солевого равновесия, Участие в иммунной защите организма
В соединительной ткани различают: межклеточное (основное) вещество, клеточные элементы, волокнистые структуры (коллагеновые волокна). Особенность: межклеточного вещества гораздо больше, чем клеточных элементов. В интерстициальном внутритканевом пространстве между животными клетками находится сложное межклеточное вещество, экстрацеллюлярный матрикс. Главные компоненты межклеточного матрикса: прочные коллагены, сетчатые адгезивные белки и основное вещество, протеогликаны. Он обеспечивает механические контакты между клетками, образует механически прочные структуры, такие, как кости, хрящ, сухожилия и суставы, составляет основу фильтрующих мембран (например, в почках), изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток), формирует пути миграции клеток, вдоль которых они могут перемещаться, например при эмбриональном развитии. Клеточные элементы соединительной ткани- это фиброблсты, тучные клетки, макрофаги. В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50% за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
В межклеточном матриксе находятся 2 типа волокнистых структур: коллагеновые и эластиновые волокна. Основным их компонентом является нерастворимый белок коллаген.
Типичная молекула коллагена состоит из трех полипептидных целей разных типов (α-спиралей), скрученных в виде правой тройной спирали. Известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. Коллагены входят в состав фибрилл (фибриллообразующие коллагены- I, II, III, V и XI типы), миофибрилл (коллаген VI типа), являются структурным компонентом базальных мембран (коллаген IV типа) и т.д.
2-й вид волокон - эластические. В основе строения - белок эластин. Эластин еще более гидрофобен, чем коллаген. В нем до 90% гидрофобных аминокислот.
Эластин - это основной структурный компонент эластических волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие). Свойства эластичности проявляются высокой растяжимостью этих тканей и быстрым восстановлением исходной формы и размера после снятия нагрузки. Эластин — гликопротеин с молекулярной массой 70 кД, который содержит много гидрофобных аминокислот. В отличие от большинства белков пептидные цепи эластина не приобретают ха-рактерную третичную структуру, а сохраняют гибкую случайную конформацию.
В межклеточном матриксе молекулы эластина образуют волокна, сети, слои, в которых отдельные молекулы связаны множеством сшивок.
Наличие гибкой случайной конформации молекул эластина и большого количества поперечных сшивок позволяет эластическим волокнам проявлять свои резиновоподобные свойства.
Блок 3 Концентрация кальция внутри клеток зависит от его концентрации во внеклеточной жидкости.
Многие процессы в организме регулируются кальцием, при участии специфически распознающих его белков (кальмодулина, кальэлектринов, кальпаинов и т.д.). От кальция зависит генерация потенциалов действия и электромеханическое сопряжение, передача гормонального сигнала и клеточная локомоция. Кальций регулирует и скорость жизненно важных внеклеточных процессов — например, свёртывания крови. Избыток кальция может вызывать нарушение этих процессов, апоптоз или гибель клеток.
Кальций плохо всасывается в ЖКТ, выводится почками и потовыми железами. В плазме 40% кальция связано с альбумином, 15% - с кислыми органическими анионами. Остальное количество – свободная форма.
Основными регуляторами обмена Са2+ в крови являются паратгормон, кальцитриол и кальцитонин.
ПТГ стимулирует мобилизацию кальция из кости; стимулирует реабсорбцию ионов кальция в дистальных канальцах почек; активирует образование 1,25(ОН) 2 D3 в почках, что приводит к стимуляции всасывания Са2+ в кишечнике. Кальцитриол стимулируют всасывание кальция и фосфатов в кишечнике и мобилизация кальция из кости. Кальцитонин ингибирует высвобождение Са2+ из кости и стимулирует его экскрецию почками с мочой.
Уровень ионизированного кальция в плазме регулируется взаимодействующими гормонами паратиреокринином и кальцитонином, а также витамином D. Под их контролем, приблизительно 0,5 г кальция в сутки у взрослого индивида обменивается между скелетом и плазмой крови.
Метаболизм кальция в организме тесно переплетён с обменом фосфатов, связывающих большую часть внеклеточного кальция в виде кристаллов гидроксиапатита в композитных минерализованных структурах — костях.
Фосфор абсорбируется в ЖКТ очень активно. Для диагностики нарушений фосфорно-кальциевого обмена, концентрации фосфора в крови, следует определять натощак, так как, в отличие от уровня кальция, они растут после еды.
В тощей кишке всасывается до 90% суточного потребления фосфатов. Почки экскретируют 15% фильтрующихся фосфатов с мочой, в равновесном с поступлением этих ионов режиме. Фосфат может активно секретироваться в канальцах. Реабсорбция фосфата происходит на 9/10 — в проксимальных канальцах, а на 1/10 — в более дистальных частях нефрона.
В дополнение к 85% фосфора, депонированным в костях и зубах, мягкие ткани содержат существенную часть связанного фосфора и фосфат-аниона (до 14%). Всего 1% фосфора находится во внеклеточной жидкости. Макроэргические фосфатные соединения и фосфорилированные активные метаболиты в норме не могут свободно покидать клетки. Поэтому, только 12% фосфатов плазмы связано с белками, остальные представлены свободными фосфат-анионами. Уровень фосфора в плазме зависит от факторов, регулирующих обмен кальция.
Процессы депонирования кальция и фосфора в костях и их абсорбции/экскреции в кишечнике и почках взаимно сбалансированы так, что концентрация этих ионов в крови изменяется в весьма узких пределах.
ВАРИАНТ №7
Блок 1 Тканевой активатор плазминогена являются основными физиологическими активаторами плазминогена. Тканевой активатор плазминогена продуцируется эндотелиальными клетками и вызывает частичный про-теолизплазминогена, в результате чего превращается в плазмин. Отличительной особенностью тканевого активатора является высокое сродство к фибрину, который в сотни раз ускоряет его действие на плазминоген. В результате тканевой активатор с большей скоростью активирует те молекулы плазминогена, которые адсорбированы на нитях фибрина. Таким образом, действие тканевого активатора плазминогена ограничивается фибрином тромба. Попадая в кровоток, тканевой активатор связывается со специфическим ингибитором и поэтому мало действует на циркулирующий в крови плазминоген, а также в меньшей степени снижает уровень фибриногена.
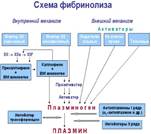
Тканевый активатор плазминогена (ТАП) -протеолитический фермент, содержащийся в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе.Растворение фибринового сгустка происходит при взаимодействии фибрина, плазминогена и ТАП. Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазмино-гена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина).ТАП ингибируется ингибиторами тканевого активатора плазмина первого (и-ТАП-1) и второго (и-ТАП-2) типов, а плазмин - α2-антиплазмином или другими ингибиторами сериновых протеаз. Ингибиторы плазмина: Хлор-эстеразный ингибитор, Антиплазмин альфа2-,Макроглобулин альфа2-,Антитрипсин альфа1-
Блок 2 ГАГ
По строению мономеров различают 7 типов глюкозаминогликанов.
1. Гиалуроновая кислота.
2. Хондроитин-4-сульфат.
3. Хондроитин-6-сульфат.
4. Дерматансульфат.
5. Кератансульфат.
6. Гепарансульфат.
7. Гепарин.
• Гиалуроновая кислота.
Молекулярная масса этого полимера- до 1 000 000 Da. Мономер построен из глюкуроновой кислоты и N-ацетилглюкозамина. Внутри мономера - 1,3-бета-гликозидная связь, между мономерами - 1,4-бета-гликозидная связь. Гиалуроновая кислота может находиться и в свободном виде, и в составе сложных агрегатов. Это единственный представитель глюкозаминогликанов, который не сульфатирован.
• Хондроитин-сульфаты.
Два вида:хондроитин-4-сульфат и хондроитин-6-сульфат. Отличаются друг от друга местом расположения остатка серной кислоты. Все они содержат остаток серной кислоты. Мономер хондроитин-сульфата построен из глюкуроновой кислоты и N-ацетилгалактозаминсульфата.
Встречаются в связках суставов и в ткани зуба.
• Дерматан-сульфат.
Его мономер построен из идуроновой кислоты и галактозамин-4-сульфата. Он является одним из структурных компонентов хрящевой ткани.
• Кератан-сульфат.
Мономер кератан-сульфата состоит из галактозы и N-ацетилглюкозамин-6-сульфата.
• Гепатан-сульфат и гепарин.
Они сильно сульфатированы (в мономере 2-3 остатка серной кислоты). В состав их входят глюкуронат-2-сульфат и N-ацетилглюкозамин-6-сульфат.
Длинные полисахаридные цепи складываются в глобулы.Однако эти глобулы рыхлые (не имеют компактной укладки) и занимают сравнительно большой объем. Глюкозаминогликаны являются гидрофильными соединениями, содержат много гидроксильных групп, имеют значительный отрицательный заряд (много карбоксильных и сульфогрупп). Значительный отрицательный заряд способствует присоединению к ним положительно заряженных катионов калия, натрия, кальция, магния. Это еще более увеличивает способность удерживать воду, а также способствует диссоциации молекул этих веществ в соединительной ткани. Глюкозаминогликаны входят в состав сложных белков, которые называются протеогликанами. Глюкозаминогликаны составляют в протеогликанах 95 % их веса. Остальные 5 % веса - это белок.
Белковый и небелковый компоненты в протеогликанах связаны прочными, ковалентными связями. Как построена молекула протеогликанов?
Белковый компонент- это особый COR-белок. К нему при помощи трисахаридов присоединяются глюкозаминогликаны. 1 молекула COR-белка может присоединить до 100 ГАГ. В клетке протеогликанысвязаны с гиалуроновой кислотой. Образуется сложный надмолекулярный комплекс. В его составе: гиалуроновая кислота, особые связующие белки, а также протеогликаны. Упругие цепи глюкозаминогликанов в составе протеогликанов образуют образуют макромолекулярные сетчатые структуры. Такое химическое строение обеспечивает выполнение функции молекулярного сита с определенными размерами пор при транспорте различных веществ и метаболитов. Размер пор определяется типом ГАГ, преобладающим в данной конкретной ткани. Например, соединительнотканая капсула почечного клубочка обеспечивает селективный транспорт веществ в процессе ультрафильтрации. За счет множества сульфо- и карбоксильных групп сетчатые структуры являются полианионами, способными депонировать воду, некоторые катионы (К+, Na+, Ca+2, Mg+2). Кроме протеогликанов, основное вещество содержит гликопротеины.
Гликопротеины.
Их углеводный компонент- это олигосахарид, состоящий 10-15 мономерных единиц. Этими мономерными единицами могут быть в основном минорные моносахариды: манноза, метилпентозырамноза и фукоза, арабиноза, ксилоза. На конце этого олигосахарида имеется еще одно производное моносахаридов: сиаловые кислоты (ацильные производные нейраминовой кислоты). Если в крови увеличивается концентрация сиаловых кислот - значит, идет распад межклеточного матрикса. Это бывает при воспалении.
Гликопротеины делят на 2 группы:
1. растворимые;
2. нерастворимые.
Углеводная часть гликопротеинов очень вариабельна. Важное значение имеет последовательность моносахаридов, как и последовательность аминокислот в белковой части.
Из гликопротеинов наиболее изучены растворимый фибронектин и нерастворимый ламинин. Растворимые гликопротеины представлены особым белком - фибронектином. Молекулярная масса фибронектина - 440 kDa. Он состоит из двух полипептидных цепей, соединенных дисульфидным мостиком. Имеет центры связывания с протеогликанами, с волокнистыми структурами, гликолипидами клеточных мембран. Поэтому фибронектин называют "молекулярным клеем". Он обычно располагается на поверхности фибробластов и участвует в адгезии всех перечисленных клеточных структур, а, значит, и клеток. Известно, что при опухолевых заболеваниях количество фибронектина снижается, что способствует метастазированию опухоли.
К растворимым гликопротеинам также относятся COR-белок - компонент протеогликанов, связующие белки, а также целый ряд белков плазмы крови.
Нерастворимые гликопротеины образуют "каркас", "строму" межклеточного матрикса. К нерастворимым гликопротеинам относится ламинин. Молекулярная масса этого белка - 10 000 kDa. Содержит такие же углеводные компоненты, как и ганглиозиды клеточных мембран. Углеводные компоненты гликопротеинов также, как и углеводные компоненты гликопротеинов обладают свойствами тканевых антигенов.
Блок 3 Течению этой симтоматикеспособстовало повышение кальция в организме. Из-за опухоли паращитовидки у больного увеличенпаратгормон. Ищзбыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани,усилениюреабсорбции кальция и выведению фосфатов в почках.Вследствии этого возникает гиперкальциемия,которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии.У больных появляеться общая и мышечная слабость,быстрая утомляемость.
Вариант 8 альбумины
1.В количественном отношении среди белков плазмы наиболее представлен альбумин (около 45 г/л), который играет существенную роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот. Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Са2+ и Mg2+. Альбумин также переносит некоторые лекарственные препараты. К альбуминовой фракции принадлежит также транстиретин (преальбумин), который вместе с тироксинсвязывающим глобулином и альбумином транспортирует гормон тироксин и его метаболит иодтиронин.
Альбумины – простые низкомолекулярные гидрофильные белки. В молекуле альбумина содержится 600 аминокислот. Молекулярная масса 67 кДа. Альбумины, как и большинство других белков плазмы крови, синтезируются в печени. Примерно 40% альбуминов находится в плазме крови, остальное количество - в интерстициальной жидкости и в лимфе.
Дата добавления: 2015-10-29; просмотров: 110 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Блок 3Этапы минерализации костной ткани | | | Эффективность использования оборотных средств(Об С) |