
|
Читайте также: |
Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сигналы нервной системы, идущие из мозга при возникновении экстремальных ситуаций, требующих активной мышечной деятельности. Он должен мгновенно обеспечить мышцы и мозг источником энергии. Органы-мишени – мышцы, печень, жировая ткань и сердечно-сосудистая система.
В клетках-мишенях имеется два типа рецепторов, от которых зависит эффект адреналина. Связывание адреналина с β-адренорецепторами активирует аденилатциклазу и вызывает изменения в обмене, характерные для цАМФ. Связывание гормона с α-адренорецепторами стимулирует гуанилатциклазный путь передачи сигнала.
В печени адреналин активирует распад гликогена, в результате чего резко повышается концентрация глюкозы в крови (гипергликемический эффект). Глюкоза используется тканями (в основном мозгом и мышцами) в качестве источника энергии.
В мышцах адреналин стимулирует мобилизацию гликогена с образованием глюкозо-6-фосфата и распад глюкозо-6-фосфата до молочной кислоты с образованием АТФ.
В жировой ткани гормон стимулирует мобилизацию ТАГ. В крови повышается концентрация свободных жирных кислот, холестерола и фосфолипидов. Для мышц, сердца, почек, печени жирные кислоты являются важным источником энергии.
Таким образом, адреналин оказывает катаболическое действие.
Адреналин действует на сердечно-сосудистую систему, повышая силу и частоту сердечных сокращений, артериальное давление, расширяя мелкие артериолы
Механизм действия
Аденилатциклазная мессенджерная система
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученныхбелков: 1) рецептор гормона; 2) фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ); 3) G-белок, осуществляющий связь между аденилатциклазой и рецептором; 4) цАМФ-зависимаяпротеинкиназа, катализирующая фосфорилирование внутриклеточныхферментов или белков-мишеней, соответственно изменяя их активность; 5)фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала
Билет 13
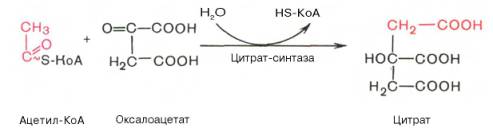
1 Цикл Кребса, его биологическое значение, регуляция.
А) Цикл трикарбоновых кислот Кребса
-цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
· 
· 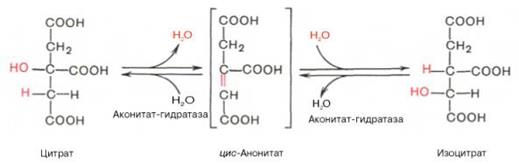
· 
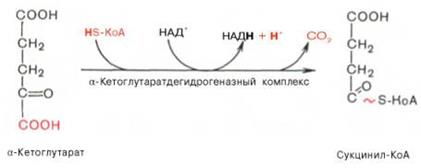
· 
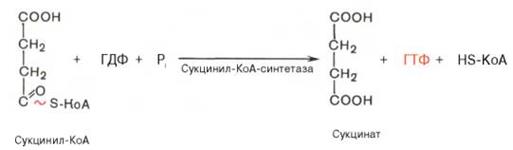
· 
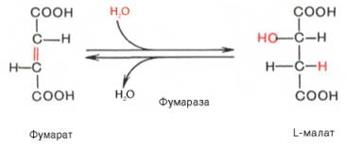
· 
· 
· 
Б)биологическое значение
- Энергетическая функция. Энергетическая эффективность выражается количеством молекул АТФ
- Анаболическая функция заключается в том, что некоторые метаболиты цикла Кребса не окисляются в нём, а используются для синтеза новых веществ.
- Взаимосвязь обмена белков, жиров, углеводов 
- Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н и одного ФАДН2.
В)регуляция
- «по механизму отрицательной обратной связи», при наличии большого количества субстратов, цикл активно работает, а при избытке продуктов реакции тормозится.
-Регуляция осуществляется при помощи гормонов, основным источником ацетил-КоА является глюкоза. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
2 Зависимость между скоростью ферментативной реакции и концентрацией субстрата. Понятие о константе Михаэлиса.
одним из наиболее существенных факторов, определяющих скорость ферментативнойреакции, является концентрация субстрата (или субстратов) и продукта (продуктов). При постоянной концентрации фермента скорость реакциипостепенно увеличивается, достигая определенного максимума (см. рис. 4.12, 4.13), когда дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т.е. все молекулы фермента связаны с субстратом. Ограничивающимскорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (Vmax) и значения константы Михаэлиса (Km) (см. рис. 4.13; 4.14).

Рис. 4.19. Зависимость скорости реакции от концентрации фермента в присутствии насыщающих концентраций субстрата.
Скорость любой ферментативной реакции непосредственно зависит отконцентрации фермента (рис. 4.19). Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрацияпродукта оказывается недостаточной для обратимости реакции. Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента.
Ферментявляется одной из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который далее подвергается распаду на продукт и свободныйфермент
Основной физический смысл константы Михаэлиса - в определении скорости биохимической (ферментативной) реакции (сродство фермента к субстракту).
Эта зависимость снижается при повышении кислотности среды и температуры. Оптимум рН для большинства ферментов находится между 5,0 и 9,0.
Скорость превращения субстрата с образованием продукта Р пропорциональна концентрации фермент-субстратного комплекса [ES]. При малых концентрациях субстрата в растворе имеется некоторое число свободных молекул фермента Е, не связанных в комплекс ES. Поэтому при увеличении концентрации субстрата концентрация комплексов растет, следовательно, растет и скорость образования продукта.
Vmax - это скорость, с которой реагирует фермент, полностью существующий в виде фермент-субстратного комплекса.
Константа Михаэлиса численно соответствует такой концентрации субстрата, при которой стационарная скорость равна половине максимальной.
Данная константа характеризует константу диссоциации фермент-субстратного комплекса:
Физический смысл константы Михаэлиса в том, что она характеризует сродство фермента к субстрату. Кт имеет малые значения, когда k1 > (k2+ k3), т. е. процесс образования комплекса ES преобладает над процессами диссоциации ES. Следовательно, чем меньше значения Кт, тем сродство фермента к субстрату больше. И, наоборот, если Кт имеет большое значение, то (k2 + k3) > k4 и процессы диссоциации ES преобладают. В этом случае сродство фермента к субстрату небольшое.
3 Синтез креатина. Креатинфосфат. Количественное определение креатинина в моче.

В синтезе креатина участвуют и другие аминокислоты - аргинин и глицин. В почках из аргинина и глицина образуется гуанидинацетат, который метилируется в печени с участием S-аденозил-метионина и в результате образуется креатин:
Гомоцистеин участвует в синтезе амикислот - цистеина (гомоцистеин + серин). Креатин подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью - креатинфосфат. Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК).
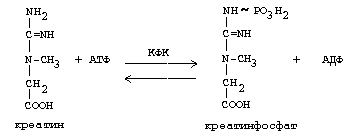
Эта реакция интенсивно идет в мышцах, особенно, в сердечной мышце, и в ткани мозга. Креатинфосфат активно синтезируется в покое и распадается при мышечной работе. Это наиболее быстрый способ регенерации АТФ. Креатин, образовавшийся из креатинфосфата распадается до креатинина, который является конечным продуктом и выводится с мочой. В сутки выводится 1-2 грамма креатинина. Это количество креатинина прямо пропорционально мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин. Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации.

При поражении мышечных клеток и нарушении ткани мозга креатинфосфокиназа появляется в крови, это является диагностическим признаком. Известно, что КФК имеет три изофермента - кардиальный, церебральный и мышечный, появление их в крови позволяет определить поражение соответствующего органа. Появление в крови кардиального изофермента является ранним диагностическим признаком инфаркта миокарда.
Количественное определение креатинина в моче
Принцип метода-Креатинин при взаимодействии с пикриновой кислотой в щелочной среде образует окрашенные соединения, интенсивность окраски которых пропорциональна концентрации креатинина в моче. Порядок выполнения работы.:В цилиндр 10-25 мл наливают 0,1 мл мочи, прибавляют 4 капли (0,1 мл) 10% раствора щелочи и 0,15 мл насыщенного раствора пикриновой кислоты. Одновременно ставят один контроль с водой, 0,1 мл дистиллированной воды и все реактивы. Взбалтывают, 5 мин, доводят дистиллированной водой до объема 10 м. Фотoметрируют против контроля на ФЭК с зеленым светофильтром в кювете на 3 мм и находят показание оптической плотности. Зная оптическую плотность опытного раствора, по готовому калибровочному графику (прилагается) определяют количество креатинина в 0,1 мл мочи и подсчитывают содержание его в моче, выделенной за сутки.
- Повышенное выделение креатинина с мочой - гиперкреатининурия - при приеме мясной пищи,размозжении мягких тканей.
-Пониженное содержание креатинина в моче - гипокреатининурия - отмечается при почечной недостаточности) мышечной атрофии, дегенерации почек, лейкемии
- Повышение уровня мочевины в моче при: злокачественной анемии (вследствие отрицательного азотистого баланса); лихорадке; после приема некоторых лекарственных препаратов,гиперфункции щитовидной железы;
-Снижение уровня мочевины в моче: во время беременности; при диете с низким содержанием белка и высоким содержанием углеводов; при заболеваниях почек и почечной недостаточности любого происхождения; при паренхиматозной желтухе.
БИЛЕТ №14
1 Окислительное декарбоксилирование пировиноградной кислоты. Ферменты и коферменты, участвующие в этом процессе.
1-ю реакцию катализирует фермент ПИРУВАТДЕКАРБОКСИЛАЗА (Е1).

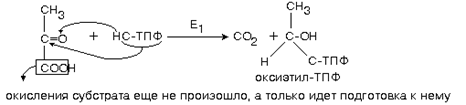
|
2-ю и 3-ю реакцию процесса катализирует фермент АЦИЛТРАНСФЕРАЗА (Е2).

3 этап - продолжает работать фермент ацилтрансфераза.
На этой стадии фермент переносит остаток уксусной кислоты на молекулу кофермента А (КоА). Поэтому его еще называют коферментом ацилирования.
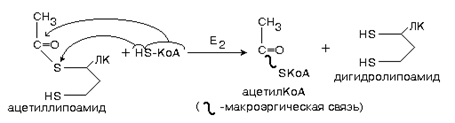
Второй фермент данного комплекса является не только ацетилтрансферазой, но и окислительным ферментом одновременно (дегидрогенизирующая ацетилтрансфераза).
Энергия этого окисления аккумулируется в виде макроэргической связи активной формы уксусной кислоты (ацетил-КоА).
4 этап катализируется ферментом ДИГИДРОЛИПОИЛДЕГИДРОГЕНАЗОЙ.
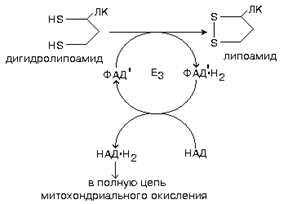
В итоге можем записать суммарное уравнение:

-----------------------------------------------------
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+ (рис. 6-20).
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль.
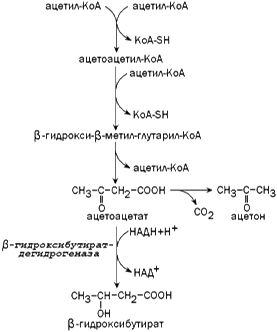
2 Кетоновые тела: структура, синтез, биологическая роль. Значение определения кетоновых тел для диагностики сахарного диабета.
Кетоновые тела — группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА:
Кетоновые тела синтезируются в печени из ацетил-КоА:[2]
На первом этапе из двух молекул ацетил-КоА синтезируется ацетоацетил-КоА. Данная реакция катализируется ферментом ацетоацетил-КоА-тиолазой.
Ac—КоА + Ac—КоА → H3C—CO—CH2—CO—S—КоА
Затем под влиянием фермента гидроксиметилглутарил-КоА-синтазы присоединяется ещё одна молекула ацетил-КоА.
H3C—CO—CH2—CO—S—КоА + Ac—КоА → HOOC—CH2—COH(CH3)—CH2—CO—S—КоА
Образовавшийся β-гидрокси-β-метилглутарил-КоА (OMG-KoA) способен под действием фермента гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоуксусную кислоту (ацетоацетат) и ацетил-КоА.
HOOC—CH2—COH(CH3)—CH2—CO—S—КоА → H3C—CO—CH2—COOH + Ac—КоА
Ацетоуксусная кислота способна восстанавливаться при участии НАД-зависимой D-β-оксибутиратдегидрогеназы; при этом образуется D-β-оксимасляная кислота (D-β-оксибутират). Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры.[2]
H3C—CO—CH2—COOH + NADH → H3C—CHOH—CH2—COOH
Ацетоуксусная кислота в процессе метаболизма способна окисляться до ацетона с выделением молекулы углекислого газа:[1]
H3C—CO—CH2—COOH → CO2 + H3C—CO—CH3
· важное значение кетоновых тел в поддержании энергетического баланса. Кетоновые тела — топливо для мышечной ткани, почек и действуют как часть регуляторного механизма с обратной связью, предотвращая излишнюю мобилизацию жирных кислот из жировых депо.
Значение определения кетоновых тел для диагностики сахарного диабета.
При β-окислении жирных кислот в митохондриях печени образуется ацетил-КоА, подвергающийся дальнейшему окислению в цикле Кребса. Если в клетках печени имеется дефицит оксалоацетата (например, при голодании, сахарном диабете), то происходит конденсация ацетильных групп с образованием кетоновых тел (ацетоацетат,β-гидроксибутират, ацетон). Эти вещества могут служить энергетическими субстратами в других тканях организма (скелетные мышцы, миокард, почки, при длительном голодании - головной мозг). Печень не утилизирует кетоновые тела. При избытке кетоновых тел в крови развивается метаболический ацидоз.
Когда в крови больного сахарным диабетом недостаточно инсулина, организм начинает сжигать белки и жиры, содержащиеся в его клетках, это приводит к выроботке ацетона. Кетоновые тела начинают отравлять организм больного и провоцируют возникновение кетоацидоза -> диабетическая кома -> смерть. Но ацетон появлется только при первом типе диабета.
Определение кетоновых тел важно в распознавании метаболической декомпенсации при сахарном диабете.
3Гормоны гипоталамуса, химическое строение и функции.
· 1. Тиреолиберин - трипептид, состоящий из пироглутаминовой кислоты, гистидина и пролинамида
В результате взаимодействия тиреолиберина с рецепторами плазматической мембраны клеток гипофиза происходит повышение концентрации внутриклеточного цАМФ и Са2+.
Тиреолиберин разрушается в клетках-мишенях и в крови под действием специфических протеаз. Т1/2 в крови составляет 3-4 мин.
· 2. Кортиколиберин - полипептид, содержащий 41 аминокислотный остаток.
В передней доле гипофиза кортиколиберин увеличивает синтез и секрецию проопиомеланокортина и образование кортикотропина. Рецепторы кортиколиберина находятся в плазматической мембране клеток в составе аденилатциклазного комплекса. Стимуляция секреции АКТГ требует присутствия ионов Са2+. Увеличение уровня внутриклеточного кальция, вероятно, является результатом фосфорилирования белков кальциевых каналов.
· 3. Гонадолиберин- декапептид. Рецептор гонадолиберина в плазматической мембране входит в состав инозитолфосфатного комплекса, активация которого стимулирует фосфорилирование белков и мобилизацию Са2+, что приводит к освобождению гормонов.
· 4. Соматолиберин - полипептид, состоящий из 44 аминокислотных остатков. В передней доле гипофиза Соматолиберин стимулирует синтез и секрецию соматотропина. Трансдукция сигнала сопровождается повышением концентрации как цАМФ, так и ионов кальция.
· 5. Соматостатин- Соматостатин выполняет функции гормона и медиатора, вызывая торможение секреторных процессов, снижение активности гладкой мускулатуры и нейронов. Соматостатин состоит из 14 аминокислотных остатков и имеет циклическую структуру, образованную дисульфидной связью между двумя остатками цистеина
Билет 19
1 Энергетический эффект анаэробного и аэробного путей распада углеводов.
Гликолиз - это серия реакций, в результате которых глюкоза распадается на две молекулы пирувата (аэробный гликолиз) или две молекулы лактата (анаэробный гликолиз). Все десять реакций гликолиза протекают в цитозоле и характерны для всех органов и тканей. Аэробный распад глюкозы включает реакции аэробного гликолиза и последующее окисление пирувата в реакциях катаболизма.
Таким образом, аэробный распад глюкозы - это предельное ее окисление до СО2 и Н2О, а анаэробный гликолиз - это специфический путь катаболизма, то есть часть аэробного распада глюкозы. Анаэробный распад включает те же реакции специфического пути распада глюкозы до пирувата, но с последующим превращением пирувата в лактат (то есть термины анаэробный распад и анаэробный гликолиз совпадают).
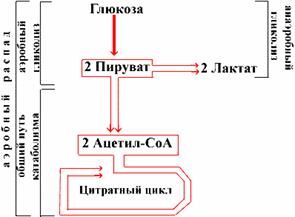 Схема катаболизма глюкозы
Схема катаболизма глюкозы
| |
| Последовательность реакций гликолза |
В гликолизе можно выделить три основных этапа. На первом этапе превращениям подвергаются гексозы, на втором - триозы, на третьем - карбоновые кислоты. Характеристика гликолиза:
| Аэробный распад глюкозы |
Энергетическое значение аэробного распада глюкозы
В аэробном гликолизе образуется 10 моль АТР на 1 моль глюкозы. Так, в реакциях 7, 10 образуется 4 моль АТР путем субстратного фосфорилирования, а в реакции 6 синтезируется 6 моль АТР (на 2 моль глицероальдегидфосфата) путем окислительного фосфорилирования:
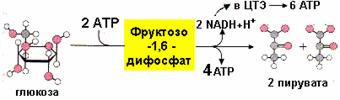 Баланс аэробного гликолиза
Баланс аэробного гликолиза
|
Суммарный эффект аэробного гликолиза составляет 8 моль АТР, так как в реакциях 1 и 3 используется 2 моль АТР. Дальнейшее окисление двух моль пируват в общих путях катаболизма сопровождается синтезом 30 моль АТР (по 15 моль на каждую молекулу пирувата. Следовательно, суммарный энергетический эффект аэробного распада глюкозы до конечных продуктов составляет 38 моль АТР.
Значение анаэробного гликолиза
Анаэробный и аэробный гликолиз энергетически неравноценны. Образование двух моль лактата из глюкозы сопровождается синтезом всего двух моль АТР, потому что NADH, полученный при окислении глицероальдегидфосфата, не используется дыхательной цепью, а акцептируется пируватом.
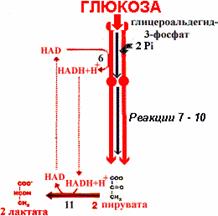 Анаэробный распад глюкозы. Реакцию 11 катализирует лактатдегидрогеназа.
Анаэробный распад глюкозы. Реакцию 11 катализирует лактатдегидрогеназа.
|
Анаэробный гликолиз, несмотря на небольшой энергетический эффект, является основным источником энергии для скелетных мышц в начальном периоде интенсивной работы, то есть в условиях, когда снабжение кислородом ограничено. Кроме того, зрелые эритроциты извлекают энергию за счет анаэробного окисления глюкозы, потому что не имеют митохондрий.
2 Способы внутриклеточной регуляции действия ферментов. Типы ингибирования ферментативной активности.
Способы регуляции активности ферментов:
Типы ингибирования.
Различают обратимое и необратимое ингибиро-вание. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных группфермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата.
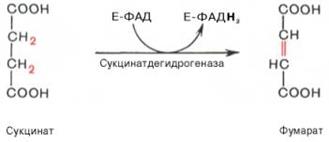
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структурусубстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Классическим примером подобного типа ингибирования является торможение сукцинатдегидрогеназы (СДГ) малоновой кислотой. Этот фермент катализируетокисление путем дегидрирования янтарной кислоты (сукцината) в фумаровую:
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
неконкурентное ингибирование также может быть обратимым и необратимым, поскольку отсутствует конкуренция между субстратом и ингибитором за активный центр. Примеры необратимого ингибирования приведены ранее. При обратимом неконкурентном ингибировании субстрат S и ингибитор I связываются с разными центрами, поэтому появляется возможность образования как комплекса EI, так и тройного комплекса EIS; последний может распадаться с освобождением продукта, но с меньшей скоростью, чем комплекс ES.
3 Биологическая роль простагландинов, лейкотриенов и тромбоксанов.
· Эйкозаноиды – обширная группа физиологически и фармакологически активных соединений. К ним относятся простаноиды (простагландины, простациклины, тромбоксаны) и лейкотриены.
· Простациклины и простагландины обладают широким спектром действия. В эндокринных железах они стимулируют образование гормонов. В жировой ткани они тормозят липолиз. Действуя на одни и те же ткани, они порой оказывают противоположный эффект:
- регулируют сокращение гладких мышц бронхов, кишечника, матки;
- оказывают влияние на сокращение миокарда;
- регулируют кровоток в почках, контролируют выведение с мочой воды и электролитов;
- регулируют проницаемость капилляров, процессы тромбообразования.
В ЦНС простагландины раздражают центры терморегуляции, вызывая повышение температуры, лихорадку. Повышают чувствительность нервных окончаний к раздражающему действию гистамина.
Простациклин образуется главным образом в сердце и сосудах, препятствует образованию тромбов, способствует расширению сосудов, уменьшает артериальное давление.
Тромбоксаны образуются в тучных клетках и тромбоцитах. Они синтезируются в самом начале образования сосудистого тромба и запускают механизм, приводящий к образованию тромба, способствуя прилипанию тромбоцитов.
Лейкотриены образуются в лейкоцитах. Их биологический эффект связан с воспалительными процессами, иммунными и аллергическими реакциями. Они способствуют прилипанию лейкоцитов к стенке сосудов в местах воспаления. Также способствуют сокращению гладкой мускулатуры, регулируют тонус сосудов, особенно стимулируя сокращение коронарных артерий.
Билет 16.
1. Трансаминирование аминокислот. Ферменты и коферменты трансаминирования. Трансдезаминирование и трансреаминирование. Диагностическое значение определения аминотрансфераз в сыворотке крови
Трансаминирование – реакции межмолекулярного переноса аминогруппы от аминокислот на альфа-кетокислоту без промежуточного образования аммиака.
Аминокислота и кетокислота обмениваются друг с другом функциональными группами. Затем аминокислота превращается в альфа-кетокислоту и наоборот.
Особенности реакции трансаминирования:
Биологическая роль:
Фермент – трансаминазы.
Коферментом для всех трансаминаз является активная форма витамина B6 – пиридоксаль фосфат (ПФ)

Трансдезаминирование заключается в непрямом пути дезаминирования. Все природные аминокислоты сначала реагируют с альфа-кетоглутровой кислотой в реакции трансаминирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глутаматдегидрогеназы.
Трансреаминирование это механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из альфа-кетокислот и аммиака. Сущность сводится к восстановительному аминированию a-кетоглутаровой кислоты с образованием глутаминовой кислоты и к последующему трансаминированию глутамата с любой альфа-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте и вновсь освобождается альфа-кетоглутаровая кислота, которая может акцептировать новую молекулу аммиака.
Для клинических целей наибольшее значение имеют две трансаминазы – аспартатаминотрансфераза (АсАТ) и Аланинаминотрансфераза (АлАТ), катализирующие соответсвующие обратимые реакции. 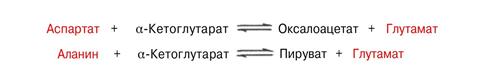
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз меньше, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях сопровождаются повышением уровня АлАТ и АсАТ в крови. Так уже через 3-5 ч после развития инфаркта миокарда уровенет АсАТ в сыворотке резко повышается. При поражении клеток печени, например при гепатите, повышается уровень АлАТ.
2.Ацетоновые (кетоновые) тела, механизм их синтеза. Значение определения ацетоновых тел в моче для диагностики сахарного диабета
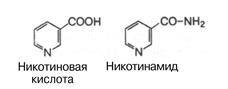
3.Витамин РР. Строение. Коферментные формы. Пищевые источники. Роль в обмене веществ. Суточная потребность.
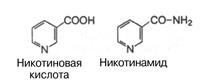
Витамин РР (Никотиновая кислота, никотинамид, ниацин) получил название также антипеллагрического витамина, поскольку его отсутствие является причиной заболевания, называемого пеллагрой.
Представляет собой соединение пиридинового ряда, содержащее карбоксильную группу.
Витамин РР мало растворим, но хорошо растворим в водных растворах щелочей. Наиболее характерными признаками авитаминоза РР, т.е. пеллагры являются дерматиты, диарея и нарушение нервной деятельности (деменция)
Биологическая роль. Витамин РР входит в состав НАД или НАДФ являющихся коферментами большого числа обратимо действующих в окислительно-восстановаительных реакциях дегидрогеназ. Никотиновая кислота широко распространена в растительных и животных организмах. Для человека источниками являются почки, хлеб, рис, картофель, мясо, морковь и др. Суточная потребность составляет 18 мг.
Билет 15
1. Уровни структурной организации белков. Первичная, вторичная, третичная и четвертичная структура белков. Связь структуры белка с биологической функцией.
Белковые молекулы представляют собой продукт полимеризации 20 различных (аминокислот, соединенных не хаотично, а в строгом соответствии с кодом белкового синтеза
Под первичной структурой представляют порядок, последовательность расположения аминокислотных остатков в полипептидной цепи.
Под вторичной структурой подразумевают конфигурацию полипептидной цепи, т.е. способ свертывания, скручивания полипептидной цепи в спиральную конформацию. Существуют альфа и бета спирали. Наиболее вероятным типом строения является альфа спираль. В структуре спиралей есть ряд закономерностей. На каждый виток альфа спирали приходится 3.6 аминокислотных остатка. Шаг спирали равен 0.54 нм на виток. Угол подъема 26 градусов.
Стабильность вторичной структуры обеспечивается водородными связями.
Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первым белком чья третичная структура стала известна – миоглобин. Полипептидная цепь представлена в виде изогнутой трубки, компактно уложенной вокруг гемма. Для стабилизации пространственной структуры играют пептидных и дисульфидные связи. А также водородные.
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой первичной, вторичной и третичной структурой и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
«Связь структуры белка с биологической функцией не нашел»
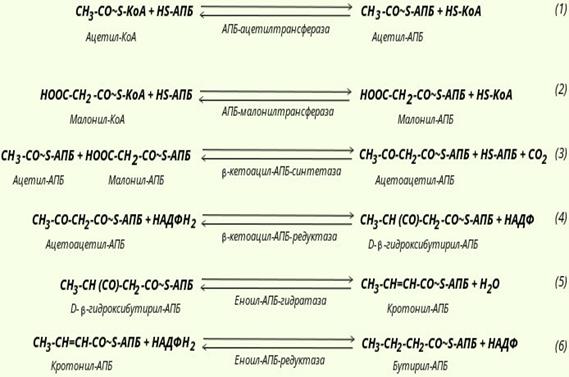
2.Биосинтез высших жирных кислот
1 этап: Образование ацетил-КоА из глюкозы
2 этап – Перенос ацетил-КоА из митохондрии в цитоплазму.
3 этап – образование малонил-КоА из ацетил-КоА
4 этап – преврещение малонил – коА (синтез пальмитиновой кислоты)
а) Начинается с переноса ацитильного и малонильного остатков при помощи ацетилтрансацелазы и малонилтрансацелазы.
Б) Корбоксильная группа малонила выделяется в виде CO2 и присоединяется ацетил образуея ацетоацетил-АПБ
В) Ацетоацетил-АПБ подвергается реакции восстановления с образованием бета-гедироксибутирил-АПБ
Г) Бета-гидроксибутирил-АПБ дегидрируется до образования кротонил-АПБ
Д) Восстановление до бутирила-АПБ (масляной кислоты)
Е) Повтор цикла
Ж) Завершается отщеплением HS-АПБ от ацил-АПБ.
3 Гормоны передней и задней доли гипофиза, химическая природа, биологическое действие.
Вазопрессин представляет собой нанопептид. Образуется в гипоталамусе, и в клетках задней доли гипофиза идет накопление.
1) Стимулирует реабсорбрцию воды в дистальном отделе нефрона
2) Суживает артериолы -> повышает АД при высоких дозах
Окситоцин представляет собой нанопептид. Биологические эффект связан со стимуляцией сокращение гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока.
Гормоны аденогипофиза.
1. Адренокортикотропный гормон (АКТГ)
Молекула АКТГ содержит 39 аминокислотных остатков.
-Оказывает стимулирующие действие на кору надпочечников -> увеличение образования глюкокортикоидов и минералкортикоидов.
-Усиливает синтез холестерина
При избытке - гиперкортицизм
2. Тиреотропный гормон или тиреотропин.
Является сложным гликопротеином и содержит, кроме того, по две альфа и бета-субъединицы.
Активирует функцию щитовидной железы
Стимулирует выработку тироксин и трийодтиронина
При избытке – тиреотоксикоз.
3. Фолликулостимулирующий гормон (ФСГ) или фоллитропин.
Вызывает рост и созревание фолликулов яичников и их подготовку к овуляции. У мужчин отвечает за образование сперматозоидов.
4. Лютеинизирущий гормон (ЛГ)
Способствует разрыву оболочки созревшего фолликула, т.е. овуляции и образования желтого тела. Стимулирует образование эстрогенов и андрогенов.
5. Соматотропный гормон.
Состоит из 191 аминокислоты и содержит две дисульфидные связи. N- и C- концевые аминокислоты представлены фенилаланином.
Участвует в росте и физическом развитии. Основано на усилении синтеза белка и метаболизма.
Действие СТГ происходит посредством соматомединов которые образуются в печени под его влиянием.
6. Проклактин.
Это крупный белок, представленный одной полипептидной цепью с тремя димульфидными связями, состоящий из 199 аминокислотных остатков.
Стимулирует рост молочных желез и способствует образованию молока.
Влияет на водно-солевой обмен.
Билет 17
1. Синтез и распад гликогена, гормональная регуляция этих процессов.
Гликоген – главная форма запасания углеводов у животных и человека.
Синтез гликогена (гликогенез)
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием
фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат. 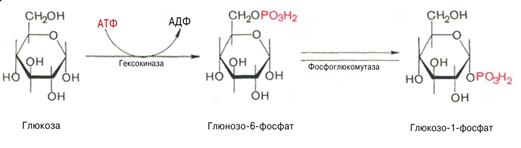
На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ, образуя УДФ-глюкоза и пирофосфат.
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена. 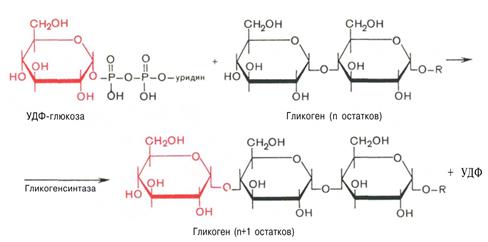
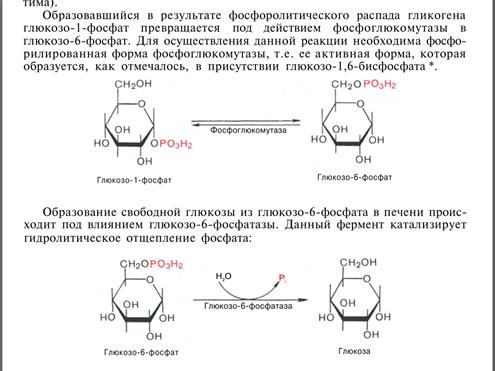
Распад гликогена (гликогенолиз)
Фосфорилазы переводят гликоген из запасной в активную форму, распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфат)
2. Понятие об активных центрах ферментов: каталитические и регуляторные центры. Аллостерические эффекторы.
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа.
В активном центр условно различают так называемый каталитический центр, непосредственно вступающий в химическое взаимодействие с субстратом, и связывающий центр, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом.Получены доказательства наличия в активном центрн химотрипсина двух остатков гистидина и остатка серина, схематически представленных в трехмерной структурной модели предшественника этого фермента. Предполагают, что формирование активного центра фермента начинается уже на ранних этапах синтеза белка-фермента на рибосоме, когда линейная одномерная структура пептидной цепи превращается в трехмерное тело строго определенной конфигурации. Любые воздействия приводящие к денатурации белка, т.е. разрушению третичной структуры приводят к искажению или разрушению структуры активного центра и соответственно потере ферементом каталитических свойств. Помимо активного центра, в молекуле фермента может присутствовать аллостерический центр, представляющий собой участок молекулы ферманта, с которым связываются определенные, обычно низкомолекулярные, вещества, молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности.Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили названием аллостерических ферментов.
3. Витамины группы А. Строение и свойства. Биологическая роль. Провитамины (каротины). Пищевые источники. Всасывание в кишечнике. Гипервитаминоз А. Суточная потребность.
Витамин А (ретинол, антиксерофтальмический витамин) хорошо изучен. Известны три витамина A: A1,A2 и цис-форма витамина A1, названная неовитамином А.
Ретинол представляет циклический непредельный одноатомный спирт, состоящий из шестичленного кольца, двух остатков изопрена и первичной спиртовой группы.
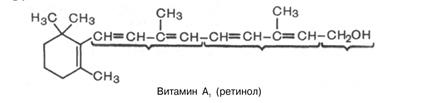
Витамин А оказывает влияние на барьерную функцию кожи, слизистых оболочек, проницаемость клеточных мембран и биосинтез их компонентов, в частности определенных гликопротеинов. Также играет значение в процессе светоощущения.
Описаны случаи гипервитаминоза А при употреблении в пищу печени белого медведя, тюленя, моржа. Характерны проявления: воспаление глаз, гиперкератоз, выпадение волос, общее истощение организма. Может возникать у детей при избытке приема рыбьего жира и препаратов витамина А.
Витамин А широко распространен. Наиболее богаты этим витамином продукты животного происхождения: печень крупного рогатого скота и свиней, яичный желток, цельное молоко, масло, сметана. Источниками витамина А для человека являются также красно-мякотные овощи (морковь, томаты, перец), в которых витамин А содержтся в виде провитаминов – каротинов, выделенных впервые из моркови. Известны 3 типа каротинов: альфа-,бета-,гамма-каротины, отличающихся друг от друга химическим строением и биологической активностью.

Суточная потребность для взрослого человека составляет в среднем 2.7 мг витамина А или от 2-5 мг B-каротина. У человека основным органом, в котором частично откладывается витамин А является печень. В норме в ней содержится около 20 мг этого витамина на 100 гр ткани.
Билет 18
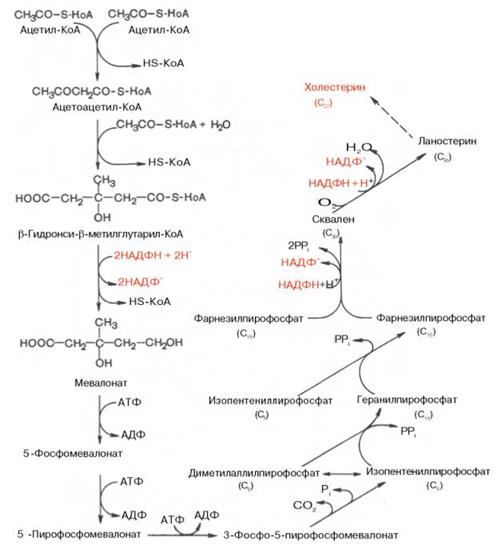
1. Стерины. Холестерин, его биологическая роль. Основные этапы синтеза холестерина. Количественное определение холестерина в сыворотке крови.
В организме человека важное место среди стероидов занимают стерины, т.е. стероидные спирты. Главным представителем является холестерин.
Каждая клетка в организме содержит холестерин. Находясь в составе мембран клеток, он обеспечивает избирательную проницаемость клеточной мембраны и на активность связанных с ней ферментов.
Холестерин – источник образования в организме млекопитающих желчных кислот, а также стероидных гормонов. Холестерин, а точнее продукт его окисления – 7-дегидрохолестерин, под действием УФ-лучей в коже превращается в витамин D3. 
В синтезе холестерина можно выделить три основные стадии:
1 – превращение активного ацетата в мевалоновую кислоту
2 – образование сквалена из мевалоновой кислоты
3 – циклизация сквалена в холестерин
Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту

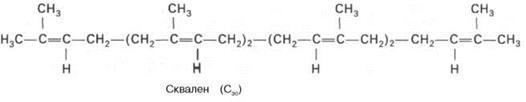
На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются сфосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты.
В заключительной реакции данной стадии в результате НАДФН-за-висимой восстановительной конденсации 2молекул фарнезилпирофосфата образуется сквален:
 На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены)
На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи в кольце В из положения 8, 9 в положение 5, 6 (детально эти последние реакции еще не изучены)
Привожу общую схему синтеза холестерина.
2. Особенности обмена дикарбоновых аминокислот.Доказана роль дикарбоновых аминокислот (глутаминовой и аспарагиновой кислот и их амидов – глутамина и аспарагина) в
интеграции азотистого обмена. 
Аспарагиновая кислота принимает непосредственное участие в орнитиновом цикле мочевинообразования, в реакциях трансаминирования и биосинтезе углеводов, карнозина и ансерина, пуриновых и пиримидиновых нуклеотидов, а также в синтезе N-ацетиласпарагиновой кислоты в ткани мозга.
Глутаминовая кислота, являющаяся гликогенной и заменимой аминокислотой для человека и животных, также включается в синтез ряда специфических метаболитов, в частности глутатиона и глутамина. Помимо участи в транспорте аммиака и регуляции кислотно-щелочного равновесия, глутамин – это незаменимый источник азота в ряде синтезов, в частносте биосинтезе пуриновых и пиримидиновых нуклеотидов, аминосахаров, в обезвреживании фенилуксусной кислоты у человека и человекообразных обезьян.
Глутамин и аспарагин оказались эссенциальными факторами для роста некоторых нормальных и опухолевых клеток в культуре ткани.
Глутамин и аспарагин в животных тканях подвергаются сочетанному трансаминированию и дезаминированию под влиянием специфических трансаминаз амидов.
Глутаминовая кислота является энергетическим материалом для ткани мозга.
3. Витамин РР. Суточная потребность. Роль в обмене веществ.
Витамин РР (Никотиновая кислота, никотинамид, ниацин) получил название также антипеллагрического витамина, поскольку его отсутствие является причиной заболевания, называемого пеллагрой.
Представляет собой соединение пиридинового ряда, содержащее карбоксильную группу.
Витамин РР мало растворим, но хорошо растворим в водных растворах щелочей. Наиболее характерными признаками авитаминоза РР, т.е. пеллагры являются дерматиты, диарея и нарушение нервной деятельности (деменция)
Биологическая роль. Витамин РР входит в состав НАД или НАДФ являющихся коферментами большого числа обратимо действующих в окислительно-восстановаительных реакциях дегидрогеназ. Никотиновая кислота широко распространена в растительных и животных организмах. Для человека источниками являются почки, хлеб, рис, картофель, мясо, морковь и др. Суточная потребность составляет 18 мг.
Билет 20
1. Сложные белки и их классификация (примеры).
Сложные белки, как было отмечено, содержат два компонента – простой белок и небелковое веществе. Последнее называют простетической группой. Простетические группы, как правило, прочно связаны с белковой молекулой. Далее представлены сведения о химической природе сложных белков.
1) Хромопротеины. Состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины(гемоглобин), магнийпорфирины(хлорофилл), флавопротеины(ксантиноксидаза). Они участвуют в фотосинтезе, дыхании клеток и целостного организма, транспорт о2 и со2. Примеры: хлорофилл, гемоглобин.
2) Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено два типа нуклеопротеинов – дезоксирибонуклеопротеины и рибонуклеопротеины.
3) Липопротеины. Этот класс сложных белков состоят из белка и простетической группы представленной каким либо липидом. В частности, в составе липопротеинов открыты нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды.К липопротеинам относится кроме того тромбопластический белок ткани легких.
4) Фосфопротеины. К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1 %; вителлин, вителлинин,фосвитин
5) Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, все антитела (иммуноглобулины), белки плазмы крови, молока, овальбумин, интерфероны.
6) Металлопротеины. К ним относятся биополимеры, содержащие помимо белка ионы какого либо одного металла или нескольких металлов. К примеру ферритин, трансферрин, гемосидерин.
2. Окислительное фосфорилирование. Хемиосмотическая теория П. Митчелла.
синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде О. ф. и его место в обмене в-в можно представить схемой:
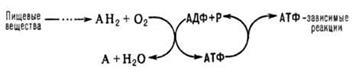
АН 2 -орг. в-ва, окисляемые в дыхат. цепи (т. наз. субстраты окисления, или дыхания), АДФ-аденозиндифосфат, Р-неорг. фосфат.
Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), О. ф. играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада О. ф. (ок. 5%).

У животных, растений и грибов О. ф. протекает в спе-циализир. субклеточных структурах-митохондриях; у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране.
Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН 2 для О. ф. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т. наз.  -окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться
-окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться  -окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
-окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
Хемиосмотическая Теория
учение о механизме преобразования энергии в биол. мембранах при синтезе аденозинтрифосфорной к-ты (АТФ). Разработана П. Митчеллом в 1961-66. Согласно исходным представлениям Митчелла, запасание энергии в АТФ происходит вследствие предварит, накопления зарядов на стенках мембраны, создания мембранного потенциала и разности концентраций протонов. Разность электрохимич. потенциалов ионов водорода на сопрягающих мембранах (внутр. мембраны митохондрий, тилакоиды хлоропластов, мембраны бактерий) возникает за счёт энергии, выделяемой при деятельности цепи окислит.-восстановит, ферментов, или за счёт поглощённых квантов света. Трансмембранные электрохимич. потенциалы ионов могут служить источником энергии не только для синтеза АТФ, на и для транспорта веществ, движения бактериальных клеток и др. энергозависимых процессов.
<Этот вопрос я не нашел в учебнике. Взял с инета>
3. Витамины группы Е. Строение. Биологическая роль
В начале 20-х годов Эванс показал, что в смешанной пище содержится вещество, которое абсолютно необходимо для нормального размножения животных. Активное вещество, предохраняющее от бесплодия, было выделено из масла пшеничных зародышей и хлопкового масла и названо витамином Е или токоферолом.
С химической точки зрения токоферолы представляют собой производные 2-метил-2 (4,8,12-триметилтридецил)-хроман-6-ола, или токола. 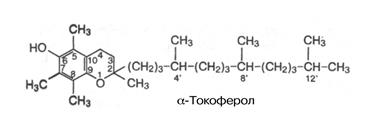
Существуют прямая связь между витамином Е и тканевым дыханием и обратная связь между этим витамином и степенью окисления липидов.
Являются главными природными жирорастворимыми антиоксидантами:разрушают наиболее реактивные формы кислорода и соответственно предохраняют от окисление полиненасыщенные жирные кислоты.
Играют специфическую роль в обмене селена. Биологическая роль витамина Е сводится, таким образом, к предотвращению аутоокисления липидов биомембран и возможному снижению потребности в глутатионпероксидазе, необходиый для разрушения образующихся в клетке перекисей. Важнейшими источниками являются растительные масла, а также салат, капуста, семена злаков, в мясе, сливочном масле, яичном желтке. Суточная потребность составляет 5 мг.
Билет №21
1.Нуклеопротеины: химические и физико-химические свойства, распространение в организме, биологическая роль. Способы выделения ДНК из клеток.
Нуклеопротеины
Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. Они составляют существенную часть рибосом, хроматина, вирусов.
Существуют 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам:
- дезоксирибонуклеопротеины (ДНП)
- рибонуклеопротеины (РНП).
У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме.
Природа синтезированных в клетках белков зависит в первую очередь от природы ДНП, точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков.
С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др.
Хроматин — это вещество хромосом, представляющее собой комплекс ДНК, РНК и белков.
В состав хроматина входят молекула ДНК, пять различных классов белков – гистонов и так называемые негистоновые белки.
Относительно белкового состава ДНП(*К?) известно, что все 5 классов гистонов различаются по размерам, аминокислотному составу и величине заряда (всегда положительный).
H1 – богатые лизином,
Н2А – богатые аргинином и лизином,
Н2В – умеренно богатые аргинином и лизином,
Н3 – богатые аргинином,
Н4 – богатые глицином и аргинином
Способы выделения ДНК
ДНК может быть выделена из любого типа тканей и клеток, содержащих ядра. Этапы выделения ДНК включают:
- быстрый лизис клеток,
-удаление фрагментов клеточных органелл и мембран с помощью центрифугирования,
-ферментативное разрушение белков протеиназами
- экстрагирование ДНК из раствора с помощью фенола и хлороформа
-осаждение ДНК этанолом
- удаления надосадочной жидкости
- растворение в буферном растворе.
Оценку качества экстрагированной ДНК проводят на основании измерения оптической плотности раствора ДНК в области белкового и нуклеинового спектров поглощения, т.е. при 280 и 260 нм, соответственно
В ходе выделения получают молекулы ДНК значительно меньше исходных, но всё равно очень большие - тысячи или десятки тысяч пар нуклеотидов. Такие молекулы неудобны для исследований, и их приходится дополнительно фрагментировать.
Способы разделения ДНК:
1.Пульс электрофорез
Метод пульс-электрофореза дает возможность разделять ДНК индивидуальных хромосом дрожжей и простейшихТаким образом, теперь существует возможность изучать целые хромосомы, последовательности ДНК которых насчитывают несколько миллионов оснований
2. Электрофорез на гель-арагозе
Смесь молекул ДНК помещают на гель агарозы. Когда через гель пропускают электрический ток, отрицательно заряженные молекулы ДНК устремляются к положительному полюсу и более мелкие молекулы движутся быстрее. Этот метод настолько чувствителен, что с его помощью можно определить длину молекулы
2.Дезаминирование аминокислот. Механизмы окислительного дезаминирования.
Дезаминирование аминокислот-процесс отщепления аминогрупп от молекулы.
Существует 4 типа дезаминирования аминокислот:
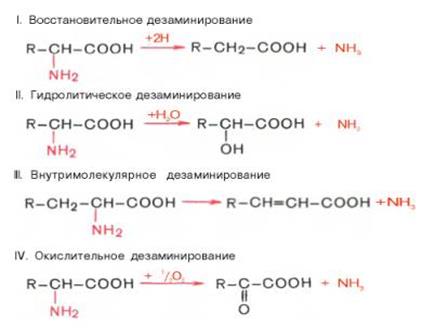
Продуктами дезаминирования являются:
-аммиак
-жирные кислоты
-окси- и кетокислоты
Механизм окислительного дезаминирования.
Окислительное дезаминирование протекает в 2 стадии:
1 стадия - ферментативная,завершается образованием неустойчивого промежуточного продукта-иминокислоты. Во 2 стадии иминокислота спонтанно без участия фермента, но в присутствии воды распадается на аммиак и a-кетокислоту.
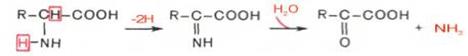
Окислительное дезаминирование аминокислот с участием коферментов:
Оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от амк.
Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД.
Оксидазы D-аминокислот – только ФАД в качестве простетической группы.

Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
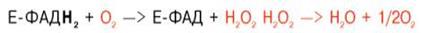
3.Гормоны щитовидной железы. Их строение и образование в организме. Гипо- и гипертиреозы.
Гормоны щитовидной железы:
-тироксин
-трийодтиронин
-кальцитонин
Строение и образование гормонов щ.ж в организме.
Гормон тироксин – это гормон из группы йодтиронинов, построенный на основе двух остатков аминокислоты тирозина и четырех атомов йода.
Биосинтез тироксина происходит в фолликулах щитовидной железы путем конденсации двух остатков молекул дийодтирозина, входящих в состав тиреоглобулина - гликопротеина, содержащего 5 тыс. аминокислотных остатков (из них 120-остатки тирозина). Иодирование остатков тирозина осуществляется иодом, к-рый образуется путем ферментативного окисления иодидов, поступающих в щитовидную железу вместе с кровью. Механизм биосинтеза тироксина включает окисление остатка дииодтирозина в тиреоглобулине до свободного радикала. Образующиеся в результате синтеза тироксина остатки пировиноградной кислоты или серина остаются в составе молекулы тиреоглобулина. Тироксин высвобождается в кровь при ферментативном гидролизе молекул тиреоглобулина в лизосомах фолликулярных клеток.
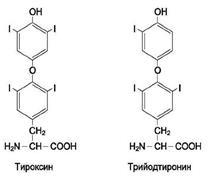
Трийодтиронин-тиреоидный гормон, отличающийся от тироксина наличием или отсутствием дополнительного атома йода в молекуле. Также представляет собой активную форму тироксина.
Кальцитонин- гормон пептидной природы. Представлен 32-членной аминокислотной последовательностью. Также содержит мостик (между 1-м и 7-м аминокислотными остатками) и характерезуется N-концевым цистеином и С-концевым пролинамидом.
Биосинтез кальцитонина осуществляется путем протеолитического расщепления прокальцитонинаКальцитонин участвует в регуляции обмена Са и Р. Действует в осн. на скелет, где тормозит резорбцию Са костной тканью. Является антагонистом паратгормона. Осн. физиол. роль кальцитонина - поддержание структуры скелета во время роста, беременности и лактации, когда потребность тканей в Са резко возрастает.
Гипо- и гипертериозы
Гипотериоз- заболевание обусловленное недостаточным содержанием в организме гормонов щитовидной железы.
1.Кретинизм(в детском возрасте)
Симптомы:остановка в росте, специфические изменения кожи, мышц, нарушение психики.
2.Миксидема(во взрослом возрасте, чаще у женщин)
Симптомы: патологическое ожирение, слизистые отеки, общие мозговые нарушения.
3. Эндемический зоб(чаще всего у людей проживающих в горных районах)
Симптомы: комперсаторное увеличение массы ткани щитовидной железы, без увеличения секреции тиреоидных гормонов.
Гипертериоз- заболевание щитовидной железы, которое вызвано избыточной секрецией тиреоидных гормонов.
«Зоб диффузный токсический» или базедова болезнь. Сопровождается триадой симптомов: резкое увеличение числа сердечных сокращений (тахикардия), пучеглазие (экзофтальм) и зоб, т.е. увеличенная в размерах щитовидная железа; у больных отмечаются общее истощение организма, а также психические расстройства.
Билет №22
1.Общие пути обмена веществ в организме. Анаболизм и катаболизм - основные процессы метаболизма.
Метаболизм - это совокупность всех химических реакций, происходящих в организме. Значение метаболизма состоит в создании необходимых организму веществ и обеспечение его энергии.
Обмен веществ:
1.Пластический (внутренний)- превращения различных соединений в организме, их перенос (транспорт) внутри организма и между организмом и средой.
2. Энергетический обмен(внешний)- превращения химической энергии, образующейся в обмене веществ, в тепло, мышечную работу, а также механизмы ее использования в активном транспорте, биосинтезе.
Выделяют две составные части метаболизма- катаболизм и анаболизм.
1.Анаболизм (ассимиляция)- синтез сложных соединений из более простых.
Анаболизм включает процессы синтеза аминокислот, моносахаридов, жирных кислот, нуклеотидов, полисахаридов, макромолекул белков, нуклеиновых кислот, АТФ
2.Катаболизм (диссимиляция)- расщепление сложных соединений до более простых.
Дата добавления: 2015-10-26; просмотров: 584 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Регуляция гликолиза | | | Writing Practice |