
Читайте также:
|
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
2 Возможные пути превращения ацетил-Коа в клетках
Ацетилкофермент А, ацетил-коэнзим А, сокращённо ацетил-КоА — важное соединение в обмене веществ, главная функция — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии.
синтез ВЖК
-поступление в цикл Кребса(энергетический)
-синтез кетоновых тел
-синтнз холестерина и его эфиров
-перенос ацетильной группы на гистоновые и негистоновые белки мембран
Билет 5
Транспорт липидов в организме идет двумя путями:
1) жирные кислоты транспортируются в крови с помощью альбуминов;
2) ТГ, ФЛ, ХС, ЭХС и д.р. липиды транспортируются в крови в составе липопротеинов.
Липопротеиды - комплекс жирных кислот и других липидов с альбумином или глобулином сыворотки крови.
Альфа-липопротеиды.
Нормальная концентрация в сыворотке крови:
у новорожденных - 0,7-1,8 г/л,
у детей до 1 года - 0,8-2,8 г/л,
у взрослых - 1,5-4,2 г/л.
Р-липопротеиды (ЛПНП).
Нормальная концентрация в сыворотке крови - 3,2- 4,5 г/л.
Гипер-альфа-липопротеинемия является защитным фактором от поражения коронарных сосудов.
Гипер-а-липопротеинемия наблюдается при:
· заболеваниях печени,
· лимфогранулематозе,
· парентеральном питании.
Гипер-Р-липопротеинемия наблюдается при:
· наследственной гиперхолестеринемии,
· гиперкортицизме,
· сахарном диабете,
· гипотиреозе.
Гипо-Р-липопротеинемия наблюдается при:
· синдроме мальабсорбции,
· муковисцирозе,
· длительном, тяжелом голодании.
Источники атомов пуринового кольца:
I. Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH2-групп – глутамин, источником энергии для реакции служит АТФ.
II. Аденозинмонофосфат (АМФ) также образуется в двух реакциях, но в качестве донора NH2-группы выступает аспарагин
Распад нуклеиновых кислот в тканях
Углеводы и фосфорная кислота используются стандартно, а азотистые основания подвергаются распаду до конечных продуктов: мочевой кислоты (пуриновые основания) и мочевины (пиримидиновые основания).
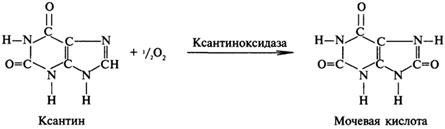
Распад пуриновых оснований происходит путём их гидролитического дезаминирования без разрыва пуринового кольца с образованием мочевой кислоты.
У взрослого человека экскретируется 0,5-1,5 г мочевой кислоты в сутки
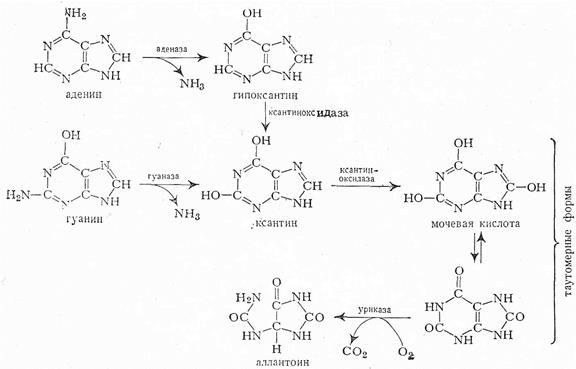
Гиперурикемия — повышенное содержание мочевой кислоты в крови.
Пода́гра - заболевание, которое характеризуется отложением в различных тканях организма кристаллов уратов в форме моноурата натрия или мочевой кислоты. поражает любые суставы
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
К незаменимым аминокислотам относятся:
фенилаланин,
метионин,
треонин,
триптофан,
валин,
лизин,
лейцин,
изолейцин.
аминокислоты аргинин и гистидин. Их относят к частично заменимым.
Остальные аминокислоты без каких-либо сложностей синтезируются в организме человека. Эти аминокислоты названы заменимыми:
глицин,
аспарагиновая кислота,
аспарагин,
глутаминовая кислота,
глутамин,
серин,
пролин,
аланин
Цветные реакции применяются для установления белковой природы вещества, идентификации белков и определения их аминокислотного состава
Реакция №1 «Биуретовая реакция на пептидную связь»
Принцип: в основе биуретовой реакции лежит способность пептидных связей (-СО-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание.
Реакция №2 «Нингидриновая реакция»
Принцип: сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот. Эта реакция характерна для аминогрупп в α-положении, которые присутствуют в природных аминокислотах и белках.
Реакция №3 «Ксантопротеиновая реакция»
Принцип: при добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, которое в присутствии щелочи переходит в оранжевое. Сущность реакции заключается в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок. Реакция выявляет наличие в белке циклических аминокислот (фенилаланин, тирозин, триптофан).
Реакция №5 «Реакция Фоля»
Принцип: аминокислоты, содержащие сульфгидрильные группы – SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и гидроокисью
Билет 6
1 Биосинтез белка. Основные компоненты белок-синтезирующей системы. Этапы синтеза белка
Условно процесс биосинтеза белка можно разделить на два этапа, имеющих разную локализацию: первый этап - цитоплазматический, второй - рибосомный.
Цитоплазматический этап биосинтеза белка. Во всех типах клеток первой стадией биосинтеза белка является превращение аминокислоты в аминоацил-тРНК. Этим достигаются две цели:
Катализируют процесс активации и отбора аминокислот ферменты аминоацил-тРНК-синтетазы (АРСазы). В общем виде этот процесс можно представить схемой:
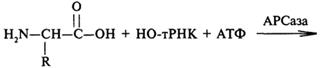
Аминокислота

Аминоацил-тРНК
Рибосомный этап биосинтеза белка. Трансляция мРНК в полипептидную цепь происходит на рибосомах. В клетках организма человека большая часть рибосом связана с мембранами эндоплазматического ретикулума.
В процессе трансляции можно выделить три этапа:
Инициация синтеза белка. Для начала синтеза полипептидной цепи необходимы: рибосома, мРНК, инициирующая N-формил-метионил-тРНКмет, белковые факторы инициации, гуанозинтрифосфорная кислота (ГТФ). Во всех синтезируемых белках первой аминокислотой является N-формилметионин, кодируемый кодоном мРНК-АУГ, названным инициирующим кодоном. Радикал формил защищает аминогруппу (N-конец) метионина растущей полипептидной цепи.
Белковые факторы трансляции - семейство белков, не входящих в состав рибосомы постоянно, взаимодействуют с ней на разных этапах трансляции. На каждом этапе синтеза полипептидной цепи принимают участие разные белковые факторы. На этапе инициации принимают участие белковые факторы инициации, отвечающие за присоединение мРНК к рибосоме и за закрепление N-формилметионил-тРНК на кодоне АУТ. тРНКмет закрепляется на кодоне АУТ с помощью комплементарного тринуклеотида УАЦ, который называется антикодоном.
В результате инициации происходит сборка транслирующей рибосомы - комплекса, состоящего из рибосомы, мРНК и N-формилметионил-тРНК. Сборка транслирующей рибосомы является энергозависимым процессом, энергию для которого поставляет гидролиз ГТФ. В транслирующей рибосоме выделяют два центра: пептидный (Р) и аминоацильный (А). На этапе инициации N-формилметионил-тРНК присоединяется к мРНК в пептидильном центре, все последующие аминоацил-тРНК присоединяются к мРНК в аминоацильном центре.
Элонгация полипептидной цепи. На этапе элонгации происходит постепенное наращивание полипептидной цепи. Для осуществления этапа элонгации необходимы: транслирующая рибосома, аминоацил-тРНК, соответствующая кодону мРНК, следующему за кодоном АУГ, фермент пептидилтрансфераза, белковые факторы элонгации, две молекулы ГТФ на каждую вновь образующуюся пептидную связь. Белковые факторы элонгации обеспечивают связывание аминоацил-тРНК с соответствующим кодоном мРНК, а также продвижение рибосомы вдоль мРНК. Пептидилтрансфераза - это фермент, обеспечивающий рост полипептидной цепи. Он является одним из белков большой субчастицы рибосомы.
Этап элонгации условно можно разбить на три стадии. Первая стадия отвечает за правильное закрепление аминоацил-тРНК на соответствующем кодоне мРНК в аминоацильном центре рибосомы. Этому способствуют белковые факторы элонгации.
На второй стадии происходит образование пептидной связи между двумя аминокислотными остатками; катализирует этот процесс пептидилтрансфераза. Сначала происходит разрыв сложно-эфирной связи между N-формилметионил-тРНКмет; затем пептидилтрансфераза осуществляет перенос N-формилметионила к аминогруппе аминоацила, закрепленного посредством тРНК в аминоацильном центре рибосомы и образует пепсидную связь. В результате действия пептидилтрансферазы в пептидильном центре остается свободная тРНКмет, а в аминоацильном - дипептидил-тРНК.
На третьей стадии элонгации происходят три перемещения. Рибосома передвигается вдоль мРНК на расстояние одного кодона. В результате такого перемещения кодон АУГ и тРНКмет оказываются за пределами рибосомы, в пептидильном центре располагается дипептидил-тРНК, а аминоацильный центр освобождается для новой аминоацил-тРНК. Третья стадия элонгации представляет собой пример направленного биологического движения, энергию для которого обеспечивает гидролиз ГТФ, называемого транслокацией. После транслокации рибосома готова к новому этапу элонгации.
Элонгация повторяется столько раз, сколько смысловых кодонов содержит мРНК. Рисунок 19 дает представление о матричном механизме биосинтеза белка на рибосоме.
Терминация полипептидной цепи. Этап терминации обеспечивают белковые факторы терминации и фермент пептидилэстераза, локализованный в большой субчастице рибосомы. Энергию для осуществления этапа терминации обеспечивает гидролиз ГТФ.
В структуре мРНК есть кодоны, не несущие информации ни об одной протеиногенной аминокислоте. Они называются бессмысленными или терминаторными. Таковыми являются кодоны УАА, УАГ, УГА. Эти кодоны (либо один из них) расположены сразу за последним смысловым кодоном мРНК. Ни одна тРНК не способна распознать терминаторные кодоны, их опознают белковые факторы терминации. Как только рибосома достигает одного из них, факторы терминации присоединяются к терминаторному кодону. В этот момент происходит активирование пептидилэстеразы, которая гидролизует сложноэфирную связь между полипептидом и последней тРНК.
Заключительной фазой терминации является диссоциация комплекса, в который входят рибосома, мРНК, тРНК, вновь синтезированный пептид и белковые факторы терминации.
Основные компоненты белоксинтезирующей системы
| Необходимые компоненты | Функции |
| 1. Аминокислоты | Субстраты для синтеза белков |
| 2. тРНК | тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном - с кодоном мРНК. |
| 3. Аминоацил-тРНК синтетазы | Каждая аа-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК |
| 4.мРНК | Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков |
| 5. Рибосомы | Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков |
| 6. АТФ, ГТФ | Источники энергии |
| 7. Белковые факторы инициации, элонгации, терминации | Специфические внерибосомные белки, необходимые для процесса трансляции (12 факторов инициации: elF; 2 фактора элонгации: eEFl, eEF2, и факторы терминации: eRF) |
| 8. Ионы магния | Кофактор, стабилизирующий структуру рибосом |
2 Глицерофосфолипиды и сфинголипиды. Строение и биологическая роль. Синтез фосфатидилхолинов.
Глицерофосфолипиды являются производными фосфатидной кислоты: в их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно азотсодержащие соединения. Общая формула глицерофосфолипидов мпредставлена на схеме, где R1 и R2 - радикалы высших жирных кислот, a R3 - радикал азотистого соединения
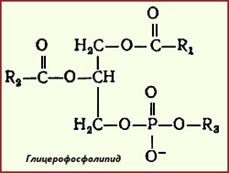
Глицерофосфолипиды подразделяют на фосфатидилхолины (лецитины), фосфатидилэта-ноламины (кефалины) и фосфатидилсерины.
Биологическая роль-образуют биологические мембраны
Сфинголипидами называется группа сложных липидов,основой молекулы которых являются алифатические аминоспирты, из которых наиболеераспространены сфингозин и церебрин.
Сфинголипиды делят на 2 основные группы:
1- Сфингофосфолипиды содержащие остатки фосфорной кислоты и холина
2- сфингогликолипиды содержащие моносахариды (обычно галактозу)
Сфингомиелины являются наиболее распространенными сфинголипидами.

Биологическая роль
I. у частие в работе иммунной систем ы
II Участие в строении и функционировании клеточных мембран
Фосфатидилхолин (или лецитин),является основной молекулой, образующей бислой мембран, внешний слой липопротеинов.
Фосфатидилхолин образуется двумя разными путями:
-Один путь биосинтеза фосфатидилхолина называют синтезом de novo («с самого начала»), поскольку в этом случае не требуется наличия предобразованного холина в качестве предшественника.
При синтезе de novo холиновая голова молекулы фосфатидилхолина не встраивается в молекулу в готовом виде, а образуется из этаноламина, входящего в состав фосфатидилэтаноламина, путем трехкратного метилирования
А) 
Б) 
- Другой путь получил название «спасательного» (salvage) пути, поскольку холин, образовавшийся при распаде фосфатидилхолина в процессе метаболизма, как бы спасается от разрушения и вновь используется в готовом виде для построения фосфатидилхолина



3.Возможные пути превращения глюкозо-6-фосфата в печени.
А)Превращение в глюкозу крови

б.) Превращение в гликоген
То количество глюкозо-6-фосфата, которое не было использовано для немедленного превращения в глюкозу крови, превращается в гликоген в результате последовательного действия фосфоглюкомутазы и гликоген-синтазы
В) Превращение в жирные килоты и холестерол
Избыток глюкозо-6-фосфата, не использованного для образования глюкозы крови или гликогена печени, распадается в ходе гликолиза и последующего действия пируватдегидрогеназы до ацетил-СоА, который превращается в малонил-СоА и далее в жирные кислоты
Г) Окислительный распад до
Ацетил-СоА, образующийся из люкозо-6-фосфата в ходе гликолиза и последующего декарбоксилирования пирувата, может быть окислен в цикле лимонной кислоты
Д) Распад по пентозофосфатному пути
Глюкозо-6-фосфат служит субстратом пентозофосфатного пути, в ходе которого образуются: 1) NADPH-восстановитель, необходимый для восстановительных этапов биосинтеза жирных кислот и холестерола и 2) D-рибозо-5-фосфат - предшественник биосинтеза нуклеотидов
Билет 7
1. Общие свойства ферментов: термолабильность, рН-зависимость, специфичность.
Ферменты - биологические катализаторы белковой природы, образуемые живой клеткой, действующие с высокой активностью и специфичностью.
А)термолабильность(чувствительность к повышению температуры)
-скорость химических реакций зависит от температуры, реакции
-Скорость химической реакции повышается в 2 раза при повышении температуры на 10°С. Однако из-за белковой природы фермента тепловая денатурация белка-фермента при повышении температуры будет снижать эффективную концентрацию фермента с последующим снижением скорости реакции. Так, примерно до 45-50°С преобладает эффект повышения скорости реакции, предсказуемый теорией химической кинетики. Выше 45°С более важной становится тепловая денатурация белка-фермента и быстрое падение скорости реакции
- При 100°С почти все ферменты утрачивают свою активность
- Оптимальной температурой для действия большинства ферментов теплокровных животных является 37-40°С.
- При низких температурах (0° или ниже) ферменты, как правило, не разрушаются (не денатурируются), хотя активность их падает почти до нуля.
Б) рН-зависимость
-При графическом изображении на кривой колоколообразной формы имеется определенная точка, при которой фермент проявляет максимальную активность; эту точку называют оптимумом pH среды для действия данного фермента

- рН-оптимум действия ферментов лежит в пределах физиологических значений. (Исключение составляет пепсин, pH-оптимум которого равен 2,0 (при pH 6,0 он не активен и не стабилен)
- влияние изменений pH среды на молекулу фермента заключается в воздействии на состояние или степень ионизации кислотных и основных групп (в частности, СООН-группы дикарбоновых аминокислот, SH-группы цистеина, имидазольного азота гистидина, NН2-группы лизина и др.).
- При разных значениях pH среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса.
В) специфичность
- Под специфичностью ферментов понимают способность каждого из них катализировать одну или несколько близких по природе хими-ческих реакций
- Специфичность у разных ферментов выражена в неодинаковой степени. Различают следующие типы специфичности.
1. А б с о л ю т н а я с п е ц и ф и ч н о с т ь. При этом типе специфичности фермент катализирует превращение только одного субстрата. (Фермент каталаза катализирует расщепление пероксида водорода на воду и кислород; ее действие ограничивается только этим субстратом.)
2. Г р у п п о в а я с п е ц и ф и ч н о с т ь. Основным признаком для ферментов этого типа специфичности служит характер разрушаемой или создаваемой связи в близких по строению группах веществ.(К ферментам с групповой специфичностью относятся липазы, катализирующие гидролиз сложных эфиров глицерина и карбоновых кислот; фосфатазы, действующие на эфиры фосфорной кислоты; пептидгидролазы, катализирующие гидролиз пептидных связей в белках и пептидах и др.)
3. С т е р е о х и м и ч е с к а я с п е ц и ф и ч н о с т ь. Ферменты этого типа специфичности действуют на определенный изомер одного и того же вещества: D- или L-, a- или b-, транс- или цис-. Пептидгидролазы действуют только на пептиды, образованные аминокислотами L-ряда.
2. Декарбоксилирование аминокислот. Образование биогенных аминов и их биологическая роль. Распад биогенных аминов.
А) Декарбоксилирование аминокислот.
- Процесс отщепления карбоксильной группы аминокислот (Продуктами реакции являются СО2 и биогенные амины)
- 4 типа декарбоксилирования аминокислот:
· α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины
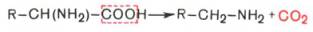
· ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:

· Декарбоксилирование, связанное с реакцией трансаминирования.В этой реакции образуются альдегид и новая аминокислота, соответствующая исходной кетокислоте.
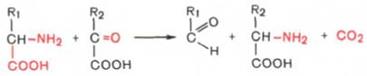
· Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Эта реакция в тканях животных осуществляется при синтезе δ-амино-левулиновой кислоты из глицина и сукцинил-КоА и при синтезе сфинголипидов, а также у растений при синтезе биотина.Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот

Б) Образование биогенных аминов и их биологическая роль.
-Образование биогенных аминов происходит с участием ферментов декарбоксилаз в присутствии кофермента пиридоксальфосфата.

-Биогенные амины являются биологически активными веществами, выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК), гормонов (адреналин), регуляторных факторов местного действия (гистамин).
В) Распад биогенных аминов.
- в общем виде сводится к окислительному дезаминированию этих аминов с образованием соответствующих альдегидов и освобождением аммиака:
- Ферменты, катализирующие эти реакции, получили название моноамин-и диаминоксидаз. Более подробно изучен механизм окислительного дез-аминирования моноаминов. Этот ферментативный процесс является необратимым и протекает в две стадии:
R-CH2-NH2+ Е-ФАД + H20-> R-CHO + NH3+ Е-ФАДН2 (1)
Е-ФАДН2 +02-> Е-ФАД + Н202 (2)
Первая (1), анаэробная, стадия характеризуется образованием альдегида, аммиака и восстановленного фермента. Последний в аэробной фазе окисляется молекулярным кислородом. Образовавшийся пероксид водорода далее распадается на воду и кислород. Моноаминоксидаза (МАО), ФАД-содержащий фермент, преимущественно локализуется в митохондриях, играет исключительно важную роль в организме, регулируя скорость биосинтеза и распада биогенных аминов.
3. Гормоны коркового вещества надпочечников. Механизм действия.
-кортикостероиды - разделяются на три основных класса, которые синтезируются и выделяются в клубочковой, пучковой и сетчатой зонах коркового вещества, соответственно:
а) Минералкортикоиды - влияют на уровни электролитов в крови и артериальное давление (у человека наиболее важен из них альдостерон);
Б) Глюкокортикоиды - оказывают выраженное действие на различные виды обмена (особенно углеводный) и на иммунную систему (главным из них у человека является кортизол);
В) Половые стероиды (главные из них у человека - дегидроэпиандростерон и его сульфат - имеют слабое андрогенное действие).
-Исходным субстратом для синтеза всех кортикостероидов служит холестерин
-Ферментные системы, участвующие в синтезе стероидных гормонов (стероидогенезе), расположены в аЭПС и митохондриях.
-Стероиды не запасаются в клетках, а образуются и выделяются непрерывно.
Билет 8
1. Классификация и номенклатура ферментов. Шифры ферментов. Примеры.
-номеклатура:Рабочее наименоваие составляют путем прибавления к корню субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментоа окончания “-аза”. Вещество, имеющее это окончание, принимают за фермент. (названия: амилаза, сахараза, уреаза,пептидаза)
- Классификация ферментов. В настоящее время известно более 2000 ферментов. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер.
· Оксидоредуктазы катализируют окислительно-восстановительные процессы.
· Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую.
· Гидролазы катализируют реакции гидролиза.
· Лиазы катализируют реакции отщепления (кроме атомов водорода) с образованием двойной связи либо присоединения по двойной связи, а также негидролитический распад органических соединений либо синтез без участия макроэргических веществ.
· Изомеразы катализируют процессы изменения геометрической или пространственной конфигурации молекул.
· Лигазы катализируют реакции синтеза, сопровождающиеся гидролизом богатой энергией связи (как правило, АТФ).
- Шифр КФ (Классификация ферментов) или код фермента — это классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для стандартизации исследований.
- примеры биохимических процессов, катализируемых ферментами, относящимися к определенному классу и подклассу.
А). Оксидоредуктазы. Общая схема

Б) Оксидазы
2. Пути обезвреживания аммиака в организме.
А) Восстановительное аминирование.
- биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина):

- важна для нервной системы, особенно чувствительной к токсическому действию аммиака.
- Глутамин затем может поступать во все ткани, где осуществляется его гидролиз при участии глутаминазы:

-Подобным образом происходит образование аспарагина (через ЩУК).
Б) Образование аммонийных солей.
- Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки
- Но она в несколько раз повышается при увеличении содержания кислот в организме.
- Аммиак в почках образуется за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки.
-Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+.
- Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами.
-Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма
В) синтез мочевины
-На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
-На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза:
-На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспаргиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининсукцинат распадается во второй реакции на аргинин и фумарат поддействием аргининосукцинат-лиазы.
-На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учёта промежуточных продуктов: СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн
ΔG° = - 40 кДж

3. Механизмы регуляции содержания глюкозы в крови. Явления гипо- и гипергликемии. Сахарный диабет. Диагностическое значение сахарных кривых.
А) -три группы механизма:
· Контроль с помощью нервных механизмов.(Возбуждение того или иного отдела ЦНС далее передача импульса по нервным стволам, далее выделение медиаторов и далее воздействие на обмен углеводов в клетке.)
· Контроль с помощью нейрогормональных механизмов.(Возбуждение подкорковых метаболических центров, выделение гормонов гипоталамуса, выделение гормонов гипофиза, выделение гормонов периферических желез внутренней секреции и наконец воздействие гормонов на метаболизм углеводов в клетке.)
· Контроль с помощью метаболитно-гуморальных механизмов. (Например повышение концентрации глюкозы в крови приводит к повышению продукции инсулина b клетками, а далее следует активация процессов усвоения глюкозы клетками.)
Б) -Гипергликемия – клинический симптом, обозначающий увеличение содержания глюкозы в сыворотке крови
-Гипогликемия – патологическое состояние, характеризующееся снижением уровня глюкозы периферической крови ниже нормы (3,3 ммоль/л).
В)- Сахарный диабет -заболевание, которое наблюдается при абсолютном или относительном дефиците инсулина.
-Нехватка этого пептидного гормона отражается на обмене углеводов и липидов.
-Сахарный диабет встречается в двух формах. При диабете I типа (инсулинзависимом сахарном диабете) уже в раннем возрасте происходит гибель инсулинсинтезирующих клеток в результате аутоиммунной реакции. Менее тяжелый диабет II типа (инсулиннезависимая форма) обычно проявляется в более пожилом возрасте. Он может быть вызван различными причинами, например пониженной секрецией инсулина или нарушением рецепторных функций.
Г) Диагностическое значение сахарных кривых- лабораторный метод исследования, используемый в эндокринологии при диагностике нарушения толерантности к глюкозе (преддиабет) и сахарного диабета. Суть теста заключается в измерении уровня сахара в крови пациента натощак, приеме сахарной нагрузки и проведении повторного исследования сахара крови через 2 часа.
Билет 9
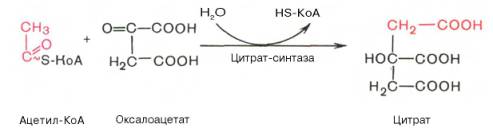
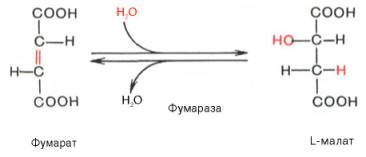
1. Цикл трикарбоновых кислот Кребса. Биологическое значение. Регуляция.
А) Цикл трикарбоновых кислот Кребса
-цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.






Б)биологическое значение
- Энергетическая функция. Энергетическая эффективность выражается количеством молекул АТФ
- Анаболическая функция заключается в том, что некоторые метаболиты цикла Кребса не окисляются в нём, а используются для синтеза новых веществ.
- Взаимосвязь обмена белков, жиров, углеводов 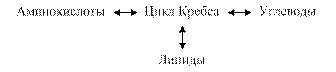
- Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н и одного ФАДН2.
В)регуляция
- «по механизму отрицательной обратной связи», при наличии большого количества субстратов, цикл активно работает, а при избытке продуктов реакции тормозится.
-Регуляция осуществляется при помощи гормонов, основным источником ацетил-КоА является глюкоза. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
2. Биосинтез нуклеиновых кислот.
-первая стадия-синтез нуклеотидов.
-На второй стадии происходит фосфорилирование нуклеотидов с образованием соответствующих ди- и трифосфатов, имеющих макроэргические фосфатные связи.
-На третьей соответствующие фосфорилированные нуклеотиды полимеризуются, и возникают молекулы ДНК и РНК.
А) -Синтез пуриновых нуклеотидов осуществляется из инозинмонофосфата [ИМФ.Его основание гипоксантин превращается в две стадии в аденин или гуанин. Образующиеся нуклеозид-монофосфаты АМФ и ГМФ переходят в дифосфаты АДФ и ГДФ под действием нуклеозидфосфаткиназ и, наконец, фосфорилируются нуклеозиддифосфаткиназами до трифосфатов АТФ и ГТФ. Нуклеозидтрифосфаты служат строительными блоками для РНК или функционируют в качестве коферментов. Преобразование рибонуклеотидов в дезоксирибонуклеотиды происходит на стадии дифосфатов и катализируется нуклеозиддифосфат-редуктазой
-Пути биосинтеза пиримидиновых нуклеотидов. Прежде всего исходный УМФ фосфорилируется до ди-, а затем трифосфата УТФ.УТФ превращается цитидинтрифосфат-синтазой в ЦТФ.Так как восстановление пиримидиновых нуклеотидов до дезоксирибонуклеотидов происходит на стадии дифосфатов, ЦТФ должен быть гидролизован фосфатазой до ЦДФ,после чего могут образоваться дЦДФ и дЦТФ.
3 Пути обезвреживания аммиака в организме. Количественное определение мочевины и креатинина в моче. Клиническое значение.
· А) Восстановительное аминирование.
- биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина):

- важна для нервной системы, особенно чувствительной к токсическому действию аммиака.
- Глутамин затем может поступать во все ткани, где осуществляется его гидролиз при участии глутаминазы:

-Подобным образом происходит образование аспарагина (через ЩУК).
Б) Образование аммонийных солей.
- Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки
- Но она в несколько раз повышается при увеличении содержания кислот в организме.
- Аммиак в почках образуется за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки.
-Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+.
- Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами.
-Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма
В) синтез мочевины
-На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
-На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза:
-На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспаргиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининсукцинат распадается во второй реакции на аргинин и фумарат поддействием аргининосукцинат-лиазы.
-На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учёта промежуточных продуктов: СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн
ΔG° = - 40 кДж

· Количественное определение мочевины и креатинина в моче. Клиническое значение
- Определение содержания мочевины в моче.Для анализа используют 0,1 мл разведенной мочи и 0,1 мл стандартного раствора мочевины и обрабатывают эти пробы так же, как и сыворотку крови.(в крови: В опытную пробирку отмеривают 0,1 мл разведенной в 10 раз сыворотки крови, в стандартную – такой же объем стандартного раствора мочевины и в контрольную – 0,1 мл дистиллированной воды. Добавляют во все пробирки по 2 мл цветного реактива и тщательно перемешивают их содержимое встряхиванием.водяная баня в течение 10 мин,охлаждают,Измеряют экстинкцию стандартной и опытной проб против контрольной на ФЭКе при 540-560 нм (светофильтр зеленый) в кювете с толщиной слоя 0,5 см.)
- Количественное определение креатинина в моче. Принцип метода-Креатинин при взаимодействии с пикриновой кислотой в щелочной среде образует окрашенные соединения, интенсивность окраски которых пропорциональна концентрации креатинина в моче. Порядок выполнения работы.:В цилиндр 10-25 мл наливают 0,1 мл мочи, прибавляют 4 капли (0,1 мл) 10% раствора щелочи и 0,15 мл насыщенного раствора пикриновой кислоты. Одновременно ставят один контроль с водой, 0,1 мл дистиллированной воды и все реактивы. Взбалтывают, 5 мин, доводят дистиллированной водой до объема 10 м. Фотoметрируют против контроля на ФЭК с зеленым светофильтром в кювете на 3 мм и находят показание оптической плотности. Зная оптическую плотность опытного раствора, по готовому калибровочному графику (прилагается) определяют количество креатинина в 0,1 мл мочи и подсчитывают содержание его в моче, выделенной за сутки.
- Повышенное выделение креатинина с мочой - гиперкреатининурия - при приеме мясной пищи,размозжении мягких тканей.
-Пониженное содержание креатинина в моче - гипокреатининурия - отмечается при почечной недостаточности) мышечной атрофии, дегенерации почек, лейкемии
- Повышение уровня мочевины в моче при: злокачественной анемии (вследствие отрицательного азотистого баланса); лихорадке; после приема некоторых лекарственных препаратов,гиперфункции щитовидной железы;
-Снижение уровня мочевины в моче: во время беременности; при диете с низким содержанием белка и высоким содержанием углеводов; при заболеваниях почек и почечной недостаточности любого происхождения; при паренхиматозной желтухе.
Билет 10
1. Моносахариды, олигосахариды. Полисахариды. Важнейшие представители. Химическое строение. Биологическая роль.
А) Моносахариды — простые углеводы, обладающие небольшой молекулярной массой.
-В зависимости от количества атомов углерода в молекуле моносахаридов их подразделяют на триозы, тетрозы, пентозы (рибоза, дезоксирибоза), гексозы (глюкоза).
- В зависимости от структурной организации молекулы моносахаридов могут иметь линейную или циклическую структуру.
- содержат карбонильную (альдегидную или кетонную) группу, поэтому их можно рассматривать как производные многоатомных спиртов.
- Важнейшими и типичными представителями моносахаридов являются глюкоза (виноградный сахар) и фруктоза (фруктовый сахар). Они изомерны друг другу и имеют молекулярную формулу С6Н12О6

- выполняют биологические функции D-формы моносахаридов (D-глюкоза (виноградный сахар или декстроза, C6H12O6) — шестиатомный сахар (гексоза)) и значительно реже L-формы.
Б) О́лигосахари́ды — углеводы, молекулы которых синтезированы из 2 — 10 остатков моносахаридов, соединённых гликозидными связями
- различают: дисахариды, трисахариды и так далее.
-Олигосахариды, состоящие из одинаковых моносахаридных остатков, называют гомополисахаридами, а из разных — гетерополисахаридами.
- Наиболее распространены среди олигосахаридов дисахариды.
-Среди природных трисахаридов наиболее распространена рафиноза — невосстанавливающий олигосахарид, содержащий остатки фруктозы, глюкозы и галактозы — в больших количествах содержится в сахарной свёкле и во многих других растениях.
- Основная масса олигосахаридов представлена дисахаридами, среди которых важную роль для организма животных играют сахароза, мальтоза и лактоза. Дисахарид целлобиоза имеет важное значение для жизни растений.
В) Полисахари́ды — общее название класса сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов. С точки зрения общих принципов сроения в группе полисахаридов возможно различить гомополисахариды, синтезированные из однотипных моносахаридных единиц и гетерополисахариды, для которых характерно наличие двух или нескольких типов мономерных остатков
-представители:крахмал, целлюлоза, гликоген
- биологическая роль:основной резерв глюкозы в организме(гликоген). способствует развитию полезных микроорганизмов(инулин). входят в состав растительных клеток (целлюлоза) и межклеточных пространств (гемицеллюлоза, пектин и его производные)
2 Механизм в-окисления высших жирных кислот. Особенности окисления высших жирных кислот с нечетным числом углеродных атомов.
А)-β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА.
-Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома.
-Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования.
- β-Окисление жирных кислот происходит только в аэробных условиях.
-β-Окисление жирных кислот, происходит в матриксе митохондрий, поэтому после активации жирные кислоты должны транспортироваться внутрь митохондрий

Б) Установлено, что жирные кислоты с нечетным числом углеродных атомов окисляются таким же образом, как и жирные кислоты с четным числом углеродных атомов, с той лишь разницей, что на последнем этапе расщепления (β-окисления) образуется одна молекула пропионил-КоА и одна молекула ацетил-КоА, а не 2 молекулы ацетил-КоА.
3 Витамин В6. Строение, свойства. Коферментные формы. Пищевые источники. Суточная потребность.
- Витамин B6 (пиридоксин)- В основе структуры витамина В6 лежит пиридиновое кольцо
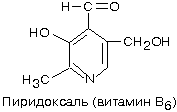
- необходим и для некоторых реакций обмена аминокислот.
- участвует в реакциях синтеза гема гемоглобина (синтез d-аминолевулиновой кислоты). Поэтому при недостатке В6 у человека развивается анемия.
-хорошо растворим в воде
- Все формы витамина В6 используются в организме для синтеза коферментов: пиридоксальфосфата и пиридоксаминфосфата. (Коферменты образуются путём фос-форилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата.)
- Пищевые источники: ржаной хлеб, горох, картофель, мясо, печень, почки.
-Суточная потребность взрослого человека: 0.15-0.20 мг.
Билет 11
1. Аминокислоты: их строение и свойства. Классификация аминокислот. Характер связи аминокислотных остатков в молекуле белка. Цветные реакции на белки.
2. Связь обмена углеводов и жиров.
3. Фолиевая кислота. Химическое строение. Участие в обмене веществ.
· Аминокисло́ты — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.

· амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
· Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
· Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
· Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
· Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
· Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде
К незаменимым аминокислотам относятся:
фенилаланин,
метионин,
треонин,
триптофан,
валин,
лизин,
лейцин,
изолейцин.
аминокислоты аргинин и гистидин. Их относят к частично заменимым.
Остальные аминокислоты без каких-либо сложностей синтезируются в организме человека. Эти аминокислоты названы заменимыми:
глицин,
аспарагиновая кислота,
аспарагин,
глутаминовая кислота,
глутамин,
серин,
пролин,
аланин
Цветные реакции применяются для установления белковой природы вещества, идентификации белков и определения их аминокислотного состава
Реакция №1 «Биуретовая реакция на пептидную связь»
Принцип: в основе биуретовой реакции лежит способность пептидных связей (-СО-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи. Раствор белка дает сине-фиолетовое окрашивание.
Реакция №2 «Нингидриновая реакция»
Принцип: сущность реакции состоит в образовании соединения, окрашенного в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот. Эта реакция характерна для аминогрупп в α-положении, которые присутствуют в природных аминокислотах и белках.
Реакция №3 «Ксантопротеиновая реакция»
Принцип: при добавлении к раствору белка концентрированной азотной кислоты и нагревании появляется желтое окрашивание, которое в присутствии щелочи переходит в оранжевое. Сущность реакции заключается в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок. Реакция выявляет наличие в белке циклических аминокислот (фенилаланин, тирозин, триптофан).
Реакция №5 «Реакция Фоля»
Принцип: аминокислоты, содержащие сульфгидрильные группы – SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и гидроокисью
Типы связей между аминокислотами в молекуле белка
2 группы:
1. Ковалентные связи - обычные прочные химические связи.
а) пептидная связь
б) дисульфидная связь
2. Нековалентные (слабые) типы связей - В десятки раз слабее обычной химической связи. Очень чувствительны к физико-химическим условиям среды. соединяются друг с другом разнообразные химические группы, но отвечающие определенным требованиям.
а) Водородная связь
б) Ионная связь
в) Гидрофобное взаимодействие
2 Связь обмена углеводов и жиров.
При распаде углеводов образуется пировиноградная кислота, а из нее -активная уксусная кислота -ацетил-КоА, который может быть использован в синтезе жирных кислот. Последние при своем распаде дают ацетил-КоА. Для синтеза нейтрального жира необходим кроме жирных кислот и глицерин. Глицерин также может синтезироваться из продуктов распада углеводов, а именно, из фосфоглицеринового альдегида и фосфодиоксиацетона. И наоборот, при распаде глицерина могут образовываться фосфотриозы.
Большое значение имеют промежуточные продукты различных веществ, например, ацетил КоА. Он образуется в ходе окисления глюкозы, жирных кислот, некоторых аминокислот. Он необходим для данного организма жирных кислот, холестерина, стероидных гормонов желчных кислот и служит основным источником энергии. Поэтому при недостатке в пище жиров дефицит ацетила КоА будет покрываться за счет повышенного распада углеводов и белков и наоборот..
Изучение общих путей метаболизма углеводов и жиров четко показывает их связь, когда промежуточные продукты распада углеводов могут стать исходными веществами для синтеза жиров и наоборот.
Глицерин через трифосфоглицериновый альдегид может включиться в синтез гликогена, а ацетил КоА, как продукт β-окисления жирных кислот, через ряд превращений приводит к образованию ПВК.
3 Фолиевая кислота
состоит из трех структурных единиц: остатка 2-амино-4-окси-6-метилптеридина (I), парааминобензойной (II) и L-глута-миновой (III)кислот:

Фолиевая кислота принимает участие в переносе одноуглеродных групп. Ее активная форма - тетрагидрофолиевая кислота является коферментом метиленпереносящих ферментов; принимает участие в биосинтезе пуриновых и пиримидиновых оснований, влияя таким образом на синтез ДНК и метаболизм аминокислот - метионина, серина, тирозина. Вместе с витамином В12 принимает участие в регуляции процессов кроветворения, оказывая антианемическое действие при макроцитарной анемии. Положительно влияет на функции кишечника и печени, повышая в последней содержание холина. Оказывает антиатеросклеротическое действие (в сочетании с витамином В6 и В12
БИЛЕТ №12
1 Анаэробное расщепление углеводов в организме, его биологическое значение. Энергетический эффект. Понятие о субстратном фосфорилировании.
· Его называют гликолиз и гликогенолиз. Гликогенолиз – это когда расщепление начинается с гликогена, а гликолиз – когда с глюкозы. Происходит в цитоплазме. Гликогенолиз начинается с фосфоролиза гликогена. Фосфоролиз – это реакция расщепления вещества с присоединением элементов фосфорной кислоты.
· Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ.
· Суммарное уравнение гликолиза можно представить следующим образом:

· Процесс гликолиза катализируется одиннадцатью ферментами.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата наглюкозу за счет АТФ.

Второй реакцией гликолиза является: ^ 
Третья реакция:

Четвертую реакцию гликолиза:

Пятая реакция – это реакция изомеризации триозофосфатов.:

Шестая реакция:

Седьмая:

Восьмая реакция:

Девятая реакция:
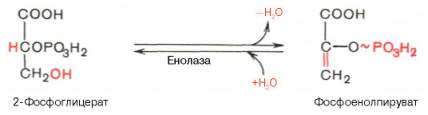
Десятая реакция:

Одтннадцатая реакция:

Биологическое значение процесса гликолиза
заключается в образовании богатых энергией фосфорных соединений. Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
Энергетический эффект
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата).
Субстратное фосфорилирование
благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилированияобразование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
2 Первичная и вторичная структура РНК. Типы РНК, особенности строения, локализация в клетке. Функции.
При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру.
Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи.
Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Основная роль РНК – непосредственное участие в биосинтезе белка. Известны три вида клеточных РНК, которые отличаются по местоположению в клетке, составу, размерам и свойствам, определяющим их специфическую роль в образовании белковых макромолекул:
- информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка; первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков.
- транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка. Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК.
- рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК. рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
3 Гормоны мозгового слоя надпочечников. Механизм действия. Влияние на обмен веществ.

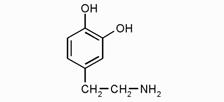 ßдофамин
ßдофамин
Эти гормоны по строению напоминают аминокислоту тирозин, от которого они отличаются наличием дополнительных ОН-групп в кольце и у β-углеродного атома боковой цепи и отсутствием карбоксильной группы
В мозговом веществе надпочечников в хромаффинных клетках синтезируются катехоламины – дофамин, адреналин и норадреналин. Непосредственным предшественником катехоламинов является тирозин. Норадреналин образуется также в нервных окончаниях симпатической нервной ткани (80% от общего количества). Катехоламины запасаются в гранулах клеток мозгового слоя надпочечников. Повышенная секреция адреналина происходит при стрессе и понижении концентрации глюкозы в крови.
Адреналин является преимущественно гормоном, норадреналин и дофамин – медиаторами симпатического звена вегетативной нервной системы.
Дата добавления: 2015-10-26; просмотров: 548 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Can - to be able | | | Биологическое действие |