
Читайте также:
|
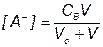


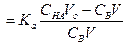
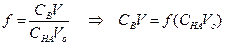
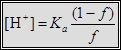

Кривые титрования 0.1, 0.01 и 0.001 М бензойной кислоты (Ка = 6.3•10–5) раствором NaOH
3) Точка эквивалентности, f = 1

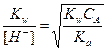
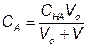
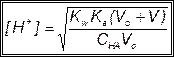
За точкой эквивалентности, f > 1
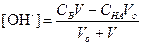
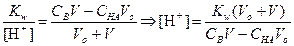
ТИТРОВАНИЕ СЛАБОГО ОСНОВАНИЯ СИЛЬНОЙ КИСЛОТОЙ
1) Начальная точка кривой титрования, f =0
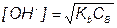
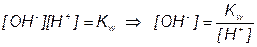

После начала титрования, f от 0 до 1


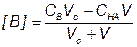

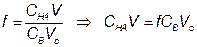

5) Точка эквивалентности, f = 1
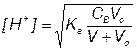
За точкой эквивалентности, f > 1
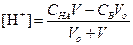
КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Ступенчатые (K) и суммарные константы (b):
M + nL 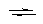 MLn
MLn

Cd2+ + I– 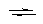 CdI+
CdI+
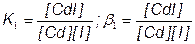
CdI+ + I– 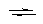 CdI2
CdI2
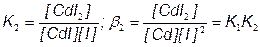
CdI2 + I– 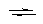 CdI3–
CdI3–
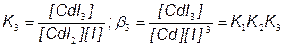
CdI3– + I– 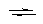 CdI42
CdI42
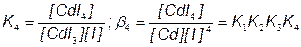
Комплексоны — соединения, содержащие аминодиуксусную группировку:
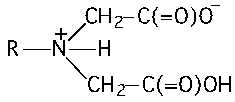
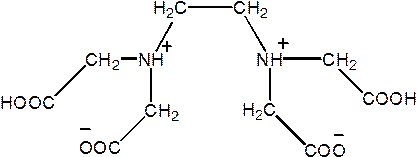
| ЭДТА | Na2(ЭДТА2–)•2H2O |
| Этилендиамин- N,N,N’,N’ -тетрауксусная кислота Этилендиаминтетрауксусная кислота Комплексон II | Двунатриевая соль ЭДТА Комплексон III Трилон Б |

КОМПЛЕКСЫ ЭДТА С МЕТАЛЛАМИ
Константы ионизации ЭДТА (p Ka; 20 °C, m = 0.1)
| HY/[Y][H] | 10.24 |
| H2Y/[HY][H] | 6.16 |
| H3Y/[H2Y][H] | 2.66 |
| H4Y/[H3Y][H] | 2.0 |
| H5Y/[H4Y][H] | 1.5 |
| H6Y/[H5Y][H] | — |
Комплексообразующая форма ЭДТА: Y4-

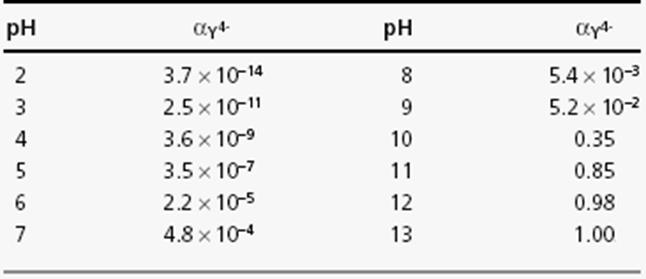
Условные константы устойчивости
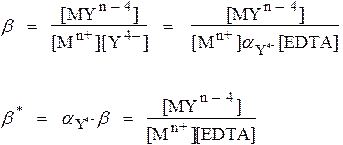

Задача: Рассчитать концентрацию свободного Ca2+ в растворах 0.1 М CaY при рН 9.0 и 4.0
b* = α b = (5.2•10–2)(5.0•1010) = 2.6•109(при рН 9.0)
b* = α b = (3.6•10–9)(5.0•1010) = 1.8•102 (при рН 4.0)
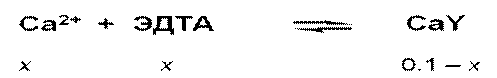

x = 1.6•10–5 (при рН 9.0)
x = 2.0•10–2 (при рН 4.0)
| Частный случай 50 мл 0.01 М Ca2+ + 0.01 M ЭДТА р Н = 10 b * = 1.75•1010 | Общий случай
M + Y  MY MY
|
| f = 0 | |
| p Ca = 2 | p M = –lg C M |
| 0 ≤ f < 1 | |
 для V = 25 мл
p Ca = 2.48
для V = 25 мл
p Ca = 2.48
|
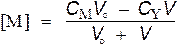 Общая концентрация металла равна сумме неоттитрованного металла и ионов металла, образующихся за счет диссоциации комплекса МY. Последним можно пренебречь.
Общая концентрация металла равна сумме неоттитрованного металла и ионов металла, образующихся за счет диссоциации комплекса МY. Последним можно пренебречь.
|
| f = 1 | |
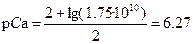
|

|
| f > 1 | |
 при V = 60 мл
р Сa = 9.54
при V = 60 мл
р Сa = 9.54
|
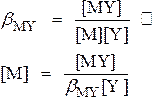
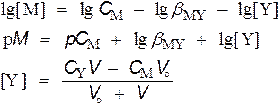
|
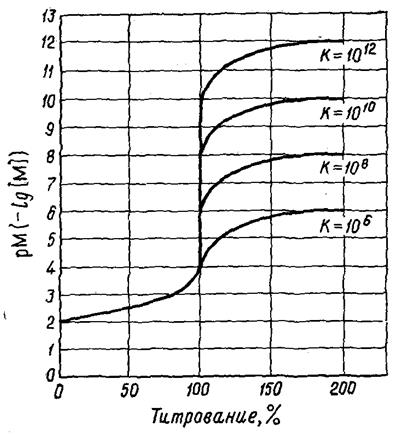
Металлоиндикаторы, мурексид
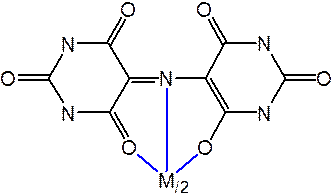
Титриметрические методы на основе реакций осаждения малорастворимых соединений
титрованиЕ 100 мл 0.1 М NaCl с помощью 0.1 М AgNO3
Сl–] до начала титрования
 = 1
= 1
Сl–] до точки эквивалентности
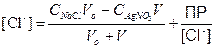
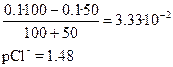
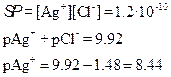
Сl–] в точке эквивалентности
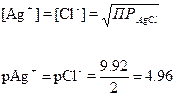
Сl–] за точкой эквивалентности

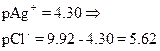
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
Окислительно-восстановительные реакции


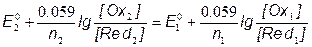
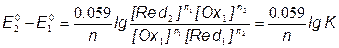
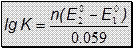
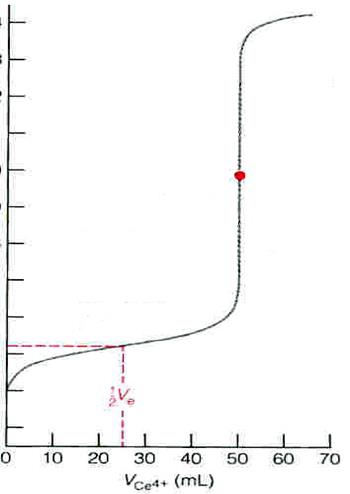
ТИТРОВАНИЕ 100.0 Мл 0.050 М РАСТВОРА Fe2+ 0.100 М РАСТВОРОМ Ce4+ В 1М HClO4:
Ce4+ + Fe2+  Ce3+ + Fe3+
Ce3+ + Fe3+
Fe3+ + 1ē  + Fe2+ E10 = 0.767B
+ Fe2+ E10 = 0.767B
Ce4+ + 1ē 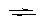 Ce3+ E20 = 1.70B
Ce3+ E20 = 1.70B
1) f=0, до начала титрования
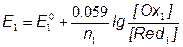
Потенциал системы определяется только аналитом-восстановителем
Для 0.050 М раствора Fe2+ в 1М HClO4 E1≈ 0.16B
Lt;f<1, начало титрования до точки эквивалентности
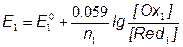 , где
, где
[Ox1] = CV/n1(V+V0)
[Red1] = (C0V0–СV)/n1(V+V0)

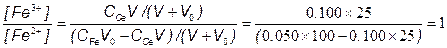 ; => E2= E20
; => E2= E20
3) f=1, в точке эквивалентности

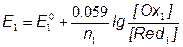 |X n1;
|X n1;
 |X n2;
|X n2;
E1 = E2 = EТЭ
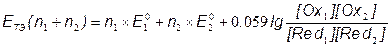 ;
;
[Ce3+] = [Fe3+]; [Ce4+] = [Fe2+];
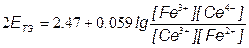 => ЕТЭ = 1.237В =
=> ЕТЭ = 1.237В = 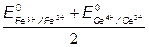
Дата добавления: 2015-10-26; просмотров: 103 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Кривая титрования 50 мл 0.1М уксусной кислоты 0.1М раствором NaOH | | | Абсолютные и относительные статистические величины |