
|
Читайте также: |
7-1. Электролиты – это вещества, растворы которых
| а) не проводят электрический ток | г) проводят тепло |
| б) проводят электрический ток | д) подкисляют раствор |
| в) не проводят тепло |
7-2. Неэлектролиты – это вещества, растворы которых
| а) не проводят электрический ток | г) проводят тепло |
| б) проводят электрический ток | д) подкисляют раствор |
| в) не проводят тепло |
7-3. Электролитами являются
| а) металлы | д) оксиды неметаллов |
| б) неметаллы | е) кислоты |
| в) оксиды металлов | ж) соли |
| г) основания | з) все органические вещества |
7-4. Уравнение процесса электролитической диссоциации:
| а) АВ D А+ + В– | в) А+ + В– D АВ |
| б) АВ D А0 + В0 | г) А+ + В– " АВ |
7-5. Значение ионного произведения воды:
| а) 7 | б) 14 | в) 18 | г) 1,8×10–16 | д) 1×10–14 |
7-6. рН раствора вычисляется по формуле:
а) 
| в) 
|
б) 
| г) 
|
7-7. Электролиты классифицируют на сильные и слабые по величине
а) 
| б) 
| в) 
| г) 
| д) 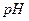
|
7-8. рН щелочного раствора:
| а) рН < 7 | б) рН = 7 | в) рН > 7 | г) не имеет рН |
7-9. Степенью электролитической диссоциации называется
а) электрическая проводимость раствора
б) отношение числа распавшихся на ионы молекул к общему числу всех молекул в растворе
в) отношение числа распавшихся на ионы молекул к числу молекул электролита в растворе
г) отношение числа ионов к изотоническому коэффициенту
7-10. Величина степени электролитической диссоциации зависит от
| а) температуры | г) концентрации раствора |
| б) природы растворителя | д) объема сосуда |
| в) цвета вещества | е) природы вещества |
7-11. Уравнения, описывающие свойства растворов, для электролитов и неэлектролитов различны, потому что электролиты
а) изменяют электропроводность раствора
б) связывают большее число молекул воды и уменьшают общее число частиц в растворе
в) распадаются на ионы и увеличивают число частиц в растворе
г) изменяют структуру воды
7-12. Гидролизу подвергаются соли, образованные
а) катионом слабого основания и анионом слабой кислоты
б) катионом слабого основания и анионом сильной кислоты
в) катионом сильного основания и анионом сильной кислоты
г) катионом сильного основания и анионом слабой кислоты
д) двузарядным катионом и однозарядным анионом
7-13. Степень гидролиза усиливается при
| а) повышении температуры | в) перемешивании раствора соли |
| б) добавлении воды | г) добавлении индикаторов |
7-14. Слабые электролиты имеют величину степени диссоциации
| а) 3% ³ a | Б) 0,03 £ a £ 0,3 | в) a £ 3% | г) a £ 0,3 |
7-15. Электролиты, при диссоциации которых из катионов образуются только катионы водорода и кислотные остатки, называются
| а) кислотными оксидами | в) основными оксидами | д) солями |
| б) основаниями | г) кислотами |
7-16. Электролиты, при диссоциации которых из анионов образуются только анионы OH– и катионы металла, называются
| а) кислотами | в) основаниями | д) солями |
| б) кислотными оксидами | г) основными оксидами |
7-17. Электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка, называются
| а) кислотными оксидами | в) основаниями | д) кислотами |
| б) солями | г) основными оксидами |
7-18. Закон разбавления Оствальда имеет вид  , где С – концентрация
, где С – концентрация
| а) молекул, не распавшихся на ионы | в) растворенного вещества |
| б) положительных ионов | г) отрицательных ионов |
7-19. Ионным произведением воды (КВ) называется
а) величина константы диссоциации воды
б) электропроводность чистой воды при стандартной температуре
в) произведение константы диссоциации воды на ее молярную концентрацию
г) логарифм величины константы диссоциации
7-20. Соответствие между степенью диссоциации веществ и силой электролита:
| 1) | Na2SO4 ( = 90%) = 90%)
| а) | сильный |
| 2) | H2SO3 ( = 25%) = 25%)
| б) | средний |
| 3) | CH3COOH ( = 2, 5%) = 2, 5%)
| в) | слабый |
| 4) | C12H22O11 ( = 0%) = 0%)
| г) | неэлектролит |
7-21. Сильные электролиты являются
а) NaOH ( = 90%) = 90%)
| в) HCN ( = 0,2%) = 0,2%)
| д) H3PO4 ( = 28%) = 28%)
|
б) Na2SO4 ( = 0,9) = 0,9)
| г) KNO3 ( = 90%) = 90%)
| е) H2S ( = 0,01%) = 0,01%)
|
7-22. Слабые электролиты являются
а) NaOH ( = 0,9) = 0,9)
| в) HCN ( = 0,2%) = 0,2%)
| д) H3PO4 ( = 28%) = 28%)
|
б) Na2SO4 ( = 90%) = 90%)
| г) KNO3 ( = 90%) = 90%)
| е) H2S ( = 0,01%) = 0,01%)
|
7-23. Уравнение для вычисления произведения растворимости сульфида серебра Ag2S:
а)  или или 
| г)  или или 
|
б)  или или 
| д)  или или 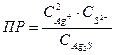
|
в)  или или 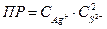
|
7-24. Соответствие между формулами электролитов и классом вещества:
| 1) | NaCl | а) | соль |
| 2) | Ba(OH)2 | б) | основание |
| 3) | H4P2O7 | в) | кислота |
| г) | металл | ||
| д) | кислотный оксид |
7-25. Выражение константы диссоциации  соответствует уравнению:
соответствует уравнению:
| а) H3PO3 D H+ + H2PO3– | в) HPO32– D H+ + PO33– |
| б) H2PO3– D H+ + HPO32– | г) H3PO3 D 3H+ + PO33– |
7-26. Среда, образуемая водным раствором Na2CO3 :
| а) кислая | в) щелочная |
| б) нейтральная | г) индикаторная |
7-27. Соответствие между обозначением и его физическим смыслом в формуле  .
.
| 1) | 
| а) | повышение температуры кипения раствора |
| 2) | i | б) | изотонический коэффициент |
| 3) | 
| в) | эбулиоскопическая постоянная |
| 4) | 
| г) | моляльная концентрация вещества |
| д) | температура кипения раствора | ||
| е) | понижение температуры кипения раствора | ||
| ж) | степень диссоциации |
7-28. Выражение  соответствует уравнению
соответствует уравнению
| а) H2CO3 D H+ + HCO3– | в) H2CO3 D 2H++ CO32– |
| б) HCO3– D H+ + CO32– | г) H2CO3 D H+2+ CO32– |
7-29. Среда, образуемая водным раствором Na2SO4
| а) кислая | в) щелочная | д) естественная |
| б) нейтральная | г) индикаторная |
7-30. Изотонический коэффициент раствора NaNO3 равен 1,8. Величина степени диссоциации α при этом
| а) 18% | б) 1,8 | в) 0,8 | г) 2 |
7-31. Степень диссоциации H2SO3 составила 25%. Тогда величина изотонического коэффициента i равна
| а) 0,25 | б) 1,5 | в) 3,0 | г) 1,25 |
7-32. Изотонический коэффициент раствора CH3COOH равен 1,04. Тогда величина степени диссоциации α
| а) 1,04 | б) 1,00 | в) 0,04 | г) 2,04 |
7-33. Уравнение первой стадии гидролиза Na2CO3
| а) Na+ + H2O D NaOH + H+. | в) CO32– + H2O D HCO3– + OH–. |
| б) CO3– + H2O D HCO3 + OH–. | г) HCO3– + H2O D H2CO3 + OH–. |
7-34. Концентрация ионов H+ в растворе с рН =1 составляет... моль/л
7-35. рН раствора с концентрацией ионов водорода 1 моль/л равен...
7-36. ПР хлорида серебра AgCl равно..., если его растворимость составляет 1,07×10–5 моль/л
| а) 1,07×10–5 | б) 2,14×10–5 | в) 1,14×10–10 | г) 1,14×10–5 |
Дата добавления: 2015-08-27; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 6. Растворы неэлектролитов. | | | Тема 8. Дисперсные системы |