
Читайте также:
|
5-1. Атомы в молекуле удерживают силы:
| а) гравитационные | в) магнитные |
| б) электрические | г) ядерные |
5-2. Ионная связь осуществляется в молекуле
| а) O2 | б) H2O | в) Li2 | г) NaCl |
5-3. Ковалентная неполярная связь осуществляется в молекуле
| а) H2 | б) H2S | в) Na2 | г) KCl |
5-4. Ковалентная полярная связь осуществляется в молекуле
| а) CaCl2 | б) O2 | в) Li2 | г) HCl |
5-5. Характеристики химической связи
| а) энергия ионизации | в) валентный угол | д) сродство к электрону |
| б) длина связи | г) энергия связи |
5-6. Металлические связи образуются в твердых веществах между
| а) атомами металлов | в) атомами металлов и неметаллов |
| б) атомами неметаллов | г) молекулами воды |
5-7. Вещество, имеющее высокую температуру плавления, блеск, ковкость, теплопроводность, электропроводность и пластичность, образовано связью
| а) ковалентной полярной | г) металлической |
| б) ковалентной неполярной | д) водородной |
| в) ионной |
5-8. Валентность – это
а) число неспаренных электронов в атоме
б) число электронов на внешнем электронном слое атома
в) число химических связей, образованных атомом
г) формальный заряд атома в молекуле
5-9. Ковалентные связи образуются между
| а) молекулами простых веществ | в) атомами металлов и неметаллов |
| б) атомами неметаллов | г) между молекулами воды |
5-10. Водородные связи образуются между
| а) атомами металлов | в) атомами металлов и неметаллов |
| б) атомами неметаллов | г) между молекулами воды |
5-11. Прочность химической связи зависит от
| а) длины связи | г) дипольного момента |
| б) кратности связи | д) насыщаемости связи |
| в) валентного угла |
5-12. Валентность атома по обменному механизму равна
| ¯ | | | ||||||
| s | p | d |
| а) 1 | б) 2 | в) 3 | г) 4 |
5-13. Наиболее короткой является связь
| а) K – Cl | б) K – Br | в) K – I | г) K – F |
5-14. Наиболее длинной является связь
| а) Na – Cl | б) Na – Br | в) K – I | г) Na – F |
5-15. Последовательность соединений по возрастанию энергии связи
| а) Na – I | б) Na – Br | в) Na – Cl | г) Na – F |
5-16. Гибридная орбиталь:
| а) | 
| б) | 
| в) | 
| г) | 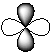
|
5-17. Ковалентная связь – это связь, которая возникает в результате электростатического притяжения между
а) общей электронной парой и положительно заряженными ядрами атомов
б) электронами и катионами, находящимися в узлах кристаллической решетки
в) атомом водорода и атомом сильно электроотрицательного элемента
г) катионом металла и анионом неметалла
5-18. Образование молекулы по обменному механизму показано на рисунке
| а) | 
|
| б) | 
|
| в) | 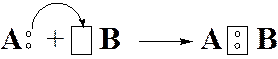
|
| г) | 
|
5-19. Образование молекулы по донорно-акцепторному механизму показано на рисунке
| а) | 
|
| б) | 
|
| в) | 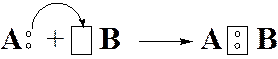
|
| г) | 
|
5-20. Последовательность возрастания энергии связи
| а) K – I | б) K – Br | в) K – Cl | г) K – F |
| ¯ | | | |
| s | p |
5-21. Атом будет проявлять
| а) донорные свойства | в) донорно-акцепторные свойства |
| б) акцепторные свойства | г) дипольные свойства |
5-22. Атом алюминия в возбужденном состоянии может проявлять
| а) донорно-акцепторные свойства | в) акцепторные свойства |
| б) донорные свойства | г) электроноакцепторные свойства |
5-23. Соответствие формулы соединения и вида химической связи:
| 1) | KCl | а) | ионная |
| 2) | H2 | б) | ковалентная неполярная |
| 3) | HCl | в) | ковалентная полярная |
| 4) | Zn | г) | металлическая |
| д) | водородная |
5-24. Донорно-акцепторная связь имеется в
| а) NH3 | б) NH4+. | в) CO2 | г) O2 |
5-25. Атом углерода в молекуле CH4 имеет гибридизацию
| а) sp | б) s2p | в) sp2 | г) sp3 |
5-26. Атом бериллия в молекуле BeCl2 имеет гибридизацию
Дата добавления: 2015-08-27; просмотров: 52 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 4. Строение атома. Периодическая система. | | | Тема 6. Растворы неэлектролитов. |