
|
Читайте также: |
6-1. Массовая доля вещества в растворе вычисляется по формуле:
а) 
| в) 
| д) 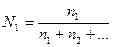
|
б) 
| г) 
|
6-2. Молярная концентрация вещества в растворе вычисляется по формуле:
а) 
| в) 
| д) 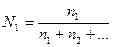
|
б) 
| г) 
|
6-3. Нормальная концентрация вещества в растворе вычисляется по формуле:
а) 
| в) 
| д) 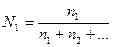
|
б) 
| г) 
|
6-4. Моляльная концентрация вычисляется по формуле:
а) 
| в) 
| д) 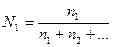
|
б) 
| г) 
|
6-5. Мольная доля вещества вычисляется по формуле:
а) 
| в) 
| д) 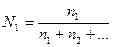
|
б) 
| г) 
|
6-6. Растворами называют
а) гетерогенные системы, состоящие из нескольких компонентов
б) гомогенные системы, изолированные от окружающей среды
в) гомогенные системы, состоящие из 2-х или более компонентов и продуктов их взаимодействия
г) гомогенные системы, образующиеся в результате установления химического равновесия между 2-мя реагирующими веществами
6-7. Концентрация – это количественная мера
а) описания состава раствора
б) содержания растворенных веществ в растворе
в) содержания растворенного вещества в растворе
г) описания способа приготовления раствора
6-8. Гидратация – это взаимодействие растворенного вещества с
| а) любым растворителем | в) другим веществом |
| б) водой | г) окружающей средой |
6-9. Осмосом называют процесс
а) диффузии вещества при растворении
б) самопроизвольного переноса вещества через полупроницаемую мембрану
в) самопроизвольного переноса растворителя через полупроницаемую мембрану
г) самопроизвольного перемешивания раствора
6-10. Соответствие способа выражения концентрации и формул
| 1) | молярная концентрация | а) | 
|
| 2) | нормальная концентрация | б) | 
|
| 3) | массовая доля вещества | в) | 
|
| 4) | мольная доля | г) | 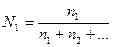
|
| 5) | моляльная концентрация | д) | 
|
| е) | 
|
6-11. Закон Рауля: при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно... растворенного вещества.
| а) массовой доле | в) молярной концентрации |
| б) молярной концентрации | г) мольной доле |
6-12. Понижение температуры замерзания раствора прямопропорционально... растворенного вещества.
| а) массой доле | в) моляльной концентрации |
| б) молярной концентрации | г) мольной доле |
6-13. Повышение температуры кипения вычисляется по формуле 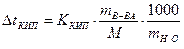 , где М
, где М
| а) масса вещества | в) молярная масса вещества |
| б) масса растворителя | г) молярная масса растворителя |
6-14. Температура замерзания раствора
а) равна температуре замерзания растворителя
б) выше температуры замерзания растворителя
в) ниже температуры замерзания растворителя
г) равна температуре замерзания растворенного вещества
д) зависит от агрегатного состояния растворителя
6-15. Соответствие между обозначением и его физическим смыслом в уравнении закона Вант-Гоффа  :
:
| 1) | Р | а) | осмотическое давление |
| 2) | С | б) | молярная концентрация |
| 3) | R | в) | универсальная газовая постоянная |
| 4) | T | г) | абсолютная температура |
| д) | атмосферное давление | ||
| е) | нормальная концентрация | ||
| ж) | время измерений |
6-16. Соответствие между обозначением и его физическим смыслом в формуле  :
:
| 1) | 
| а) | понижение температуры замерзания |
| 2) | 
| б) | криоскопическая постоянная |
| 3) | 
| в) | моляльная концентрация. |
| г) | температура замерзания | ||
| д) | повышение температуры замерзания | ||
| е) | молярная концентрация |
6-17. Осмотическое давление зависит от
| а) природы растворителя | г) концентрации растворенного вещества |
| б)температуры | д) объема раствора |
| в) природы вещества |
6-18. Зависимость растворимости газов от парциального давления
| а) | 
| в) | 
|
| б) | 
| г) | 
|
6-19. Установите соответствие между способом выражения концентрации вещества в растворе и размерностью:
| 1) | нормальная | а) | моль-экв/л. |
| 2) | моляльная | б) | моль/кг. |
| 3) | молярная | в) | моль/л. |
| 4) | массовая доля | г) | безразмерная |
| 5) | процентная концентрация | д) | % массовые |
6-20. Масса гидроксида натрия, необходимого для приготовления 200 г 20%–ного раствора.
| а) 4 г | б) 40 г | в) 400 г | г) 10 г |
6-21. Масса гидроксида натрия, необходимого для приготовления 3 л 10% –ного раствора плотностью 1,109 г/мл.
| а) 300 г | б) 300 мл | в) 332,7мл | г) 332,7г |
6-22. Масса азотной кислоты, содержащейся в в 100 миллилитрах 0,2 М раствора (молярная масса кислоты 63 г/моль).
| а) 1,26 г | б) 20 г | в) 0,1 г | г) 63 г |
6-23. Раствор, содержащий в 300 мл 10,5 г КОН, имеет молярную концентрацию (молярная масса гидроксида калия 56 г/моль)
| а) 0,625 М | б) 0,3 М | в) 0,105 М | г) 56 М |
Дата добавления: 2015-08-27; просмотров: 60 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 5. Химическая связь. | | | Тема 7. Растворы электролитов. |