
Читайте также:
|
2-1. Стандартным условиям соответствуют:
а) Т = 273К, Р = 101325 Па, n = 1 моль
б) Т = 273К, V = 1 м3, n = 1 моль
в) t = 25ºС, p = 101325 Па, n = 1 моль
г) Т = 298К, p = 101325 Па, n = 1 моль
2-2. Термодинамическими функциями являются
| а) H – энтальпия | г) U – внутренняя энергия |
| б) V – объем | д) p – давление |
| в) S– энтропия |
2-3. Стандартная размерность энтальпии
| а) Дж/г | б) кДж/кг | в) кДж/м3 | г) кДж/моль | д) Дж/мольּК |
2-4. Стандартная размерность энергии Гиббса
| а) Дж/г | б) кДж/кг | в) кДж/м3 | г) кДж/моль | д) Дж/мольּК |
2-5. Уравнение 1-го закона термодинамики
| а) DHОБР = –DHРАЗЛ | в) DG = DH – TDS |
| б) Q = DU + АВНЕШ | г) H = U – pv |
2-6. Функцию «энтальпия» определяет выражение
| а) DHОБР = –DHРАЗЛ | в) DG = DH – TDS |
| б) Q = DU + АВНЕШ | г) H = U – pV |
2-7. Эндотермическим процессам отвечает неравенство:
| а) DSХР < 0 | в) DHХР > 0 | д) DUХР = 0 |
| б) DHХР < 0 | г) DHХР = 0 |
2-8. Изолированные системы
а) не обмениваются ни веществом, ни энергией с окружающей средой
б) обмениваются веществом и не обмениваются энергией
в) обмениваются и веществом, и энергией
г) обмениваются энергией и не обмениваются веществом
2-9. Открытые системы
а) не обмениваются ни веществом, ни энергией с окружающей средой
б) обмениваются веществом и не обмениваются энергией
в) обмениваются и веществом, и энергией
г) обмениваются энергией и не обмениваются веществом
2-10. Система – это группа тел, которые
а) находятся в окружающей среде
б) отделены от окружающей среды поверхностью
в) находятся во взаимодействии и мысленно или фактически обособлены от окружающей среды
г) находятся во взаимодействии, обособлены от окружающей среды и совершают работу против внешних сил
2-11. Функция состояния системы зависит от
| а) параметров состояния | в) теплоты и работы |
| б) пути процесса | г) теплоты сгорания |
2-12. Реакции, протекающие с поглощением теплоты, называются...
| а) эпизодические | в) экзотермические |
| б) эндотермические | г) эзотерические |
2-13. Энтальпией образования вещества называется тепловой эффект...
а) реакции образования этого вещества
б) образования сложного вещества из простых веществ
в) образования сложного вещества из простых веществ, устойчивых при стандартных условиях
г) образования сложного вещества из простых веществ, устойчивых при обычных условиях
2-14. Энтальпией сгорания вещества называется тепловой эффект реакции
сгорания
а) 1 моль вещества с образованием оксидов в кислороде при обычных условиях
б) 1 моль вещества с образованием высших оксидов в кислороде при стандартных условиях
в) вещества
г) вещества в воздухе при обычных условиях
2-15. Изохорный процесс протекает при постоянном
| а) давлении | в) объеме |
| б) количестве вещества | г) температуре |
2-16. Изобарный процесс протекает при
| а) постоянном давлении | в) постоянном объеме |
| б) постоянном количестве вещества | г) постоянной температуре |
2-17. Тепловой эффект реакции, в соответствии с законом Гесса, зависит от
а) конечного и начального состояний системы и от пути процесса
б) конечного и начального состояний системы, но не зависит от пути проведения процесса
в) конечного и начального состояний системы и условий проведения процесса
г) условий проведения процесса, но не зависит от начального и конечного состояний системы
2-18. Теплота, подводимая к системе, расходуется на изменение внутренней энергии в
| а) изохорном процессе | в) изотермическом процессе |
| б) изобарном процессе | г) адиабатическом процессе |
2-19. Самопроизвольное протекание процесса в изолированной системе, в соответствии со 2-м законом термодинамики, сопровождается
а) возрастанием энтропии
б) уменьшением энтропии
в) увеличением энтальпии
г) неизменностью внутренней энергии
д) неизменностью энергии Гиббса
2-20. Самопроизвольное протекание процесса в неизолированной системе сопровождается
а) возрастанием энтропии
б) увеличением энергии Гиббса
в) уменьшением энергии Гиббса
г) неизменностью энергии Гиббса
д) совершением работы против внешних сил
2-21. Условием равновесия является
а) возрастание энтропии
б) увеличение энергии Гиббса
в) уменьшение энергии Гиббса
г) неизменность энергии Гиббса
д) совершение работы против внешних сил
2-22. Теплотой образования CO2 является тепловой эффект реакции
а) Na2CO3(Т) + 2HCl(Г) = 2NaCl(Т) + H2O(Ж) + CO2(Г)
б) 2CO(Г) + O2(Г) = 2CO2(Г)
в) C(Т) + O2(Г) = CO2(Г)
г) C(Т) + 2/3O3(Г) = CO2(Г)
2-23. Экзотермической является реакция
а) BaCO3(Т) = BaO(Т) + CO2(Г); DH = 258,7 кДж
б) CaCO3(Т) = CaO(Т) + CO2(Г); DH > 0
в) Ca(Т) + O2(Г) = CaO(Т); DH = –645,6 кДж
г) MgCO3(Т) = MgO(Т) + CO2(Г); DH = 101,6 кДж
2-24. Первое следствие из закона Гесса: тепловой эффект химической реакции равен
а) разности между суммой теплот образования исходных веществ и суммой теплот образования продуктов реакции
б) разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ
в) разности между суммой теплот образования продуктов реакции и суммой теплот сгорания исходных веществ
г) сумме теплот образования продуктов реакции и теплот образования исходных веществ
2-25. Второе следствие из закона Гесса: тепловой эффект химической реакции равен
а) разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции
б) разности между суммой теплот сгорания продуктов реакции и суммой теплот сгорания исходных веществ
в) разности между суммой теплот образования продуктов реакции и суммой теплот сгорания исходных вешеств
г) сумме теплот сгорания продуктов реакции и теплот сгорания исходных веществ
2-26. Изменение энтальпии реакции сгорания метана
CH4 + 2O2 = CO2 + 2H2O рассчитывается по уравнению
а) 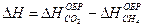
| в) 
|
б) 
| г) 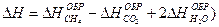
|
2-27. Изменение энтальпии при сгорании ацетилена рассчитывается по уравнению
2C2H2 + 5O2 = 4CO2 + 2H2O; DH –?
а) 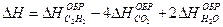
| в) 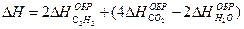
|
б) 
| г) 
|
2-28. Энтропия при протекании реакции
4NH3(Г) + 3O2(Г) = 2N2 (Г) + 6H2O(Ж)
| а) увеличивается | в) не изменяется |
| б) уменьшается | г) зависит от условий проведения реакции |
2-29. Энтропия при протекании реакции 2SO2(Г) + O2(Г) = 2SO3(Г)
| а) увеличивается | в) не изменяется |
| б) уменьшается | г) зависит от условий проведения реакции |
2-30. Изменение энтальпии реакции:
C2H5OH(Ж) + CH3COOH(Ж) = CH3COOC2H5(Ж) + H2O(Ж)
[  ;
;  ;
;
 ; ]
; ]
| а) –13 кДж | б) +13 кДж | в) –26 кДж | г) +26 кДж |
2-31. Энтальпия образования HBr
2HBr(Г) = H2(Г) + Br2(Г); DH = 72,6 кДж.
| а) 72,6 кДж/моль | в) –36,3 кДж/моль |
| б) 143,2 кДж/моль | г) –72,6 кДж/моль |
2-32. Энтальпия образования HCl составляет... кДж/моль, если при протекании реакции H2(Г) + Cl2(Г) = 2HCl(Г) выделяется 92,31 кДж.
| а) 92,31 | б) –92,31 | в) 46,155 | г) –46,155 |
2-33. Изменение энтальпии реакции
C6H6(Ж) + 7,5O2(Г) = 6CO2(Г) + 3H2O(Г) равно:
[  ;
; 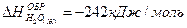 ;
;  ]
]
| а) +3133 кДж/моль | в) –3133 кДж/моль |
| б) +1566,5 кДж/моль | г) –1566,5 кДж/моль |
2-34. Условие, характеризующее самопроизвольность протекания процессов в неизолированной системе:
| а) DH > 0 | в) DG = 0 | д) DG > 0 |
| б) DH = 0 | г) DG < 0 |
2-35. Условие, характеризующее самопроизвольность протекания процессов в изолированной системе:
| а) DH > 0 | б) DH = 0 | в) DS < 0 | г) DS > 0 |
2-36. Изменение энергии Гиббса при протекании химической реакции вычисляется по формуле:
а) 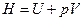
| в) 
|
б) 
| г) 
|
2-37. Формула для расчета изменения энтропии:
а) 
| в) 
|
б) 
| г) 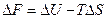
|
2-38. Самопроизвольные процессы в изолированной системе сопровождаются
| а) увеличением энтальпии | в) уменьшением энтропии |
| б) увеличением энтропии | г) уменьшением объема |
2-39. Самопроизвольные процессы в неизолированной системе сопровождаются
| а) уменьшением энергии Гиббса | в) уменьшением энтропии |
| б) увеличение энергии Гиббса | г) уменьшением объема |
2-40. Энергия Гиббса является функцией состояния, и ее изменение равно
а) сумме энергий Гиббса исходных веществ и конечных продуктов
б) разности между суммой энергий Гиббса начальных веществ и суммой энергий Гиббса конечных веществ
в) разности между суммой энергий Гиббса конечных веществ и суммой энергий Гиббса начальных веществ
г) определяется способом проведения процесса
2-41. Энтропия является функцией состояния, и ее изменение равно
а) сумме энтропий исходных веществ и конечных продуктов
б) разности между суммой энтропий начальных веществ и суммой энтропий веществ
в) разности между суммой энтропий конечных веществ и суммой энтропий начальных веществ
г) определяется способом проведения процесса
2-42. Качественно определите: энтропия при протекании реакции
N2(Г) + O2(Г) = 2NO(Г) .
| а) увеличится | в) равна нулю |
| б) не изменится | г) уменьшится |
2-43. Соответствие между словами и цифрами
|
|

| 1) | твердое | а) | |
| 2) | жидкое | б) | |
| 3) | газообразное | в) | |
| 4) | ионное |
2-44. Качественно определите изменение энтропии при протекании реакции 2C4H10(Г)+13O2(Г) = 8CO2(Г)+10H2O(Г)
| а) DS > 0 | б) DS < 0 | в) DS = 0 | г) DS» 0 |
2-45. Реакции, протекающие самопроизвольно в обратном направлении:
а) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г); DG = 170,63 кДж
б) Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2O (Г), DG = 55,28 кДж
в) 4NH3(Г) + 5O2(Г) D 4NO(Г) + 6H2(Г), DG = –959,81 кДж
г) CO(Г) + Cl2(Г) D COCl2(Г), DG < 0
2-46. Самопроизвольно в системе
Fe2O3(Т) + 3H2(Г) D 2Fe(Т) + 3H2O (Г), DG = 55,28 кДж.
будет протекать
| а) прямая реакция | в) прямая и обратная реакции равновероятны |
| б) обратная реакция | г) химические изменения невозможны |
2-47. Прямая реакция протекает самопроизвольно, если изменение свободной энергии Гиббса равно
| а) DGХР = –190 кДж/моль | в) DGХР = 0 кДж/моль |
| б) DGХР = +190 кДж/моль | г) DGХР = –DHХР |
2-48. Качественно определите: энтропия при протекании реакции
2C(Т) + 3H2(Г) = C2H6(Г)
| а) увеличится | в) равна нулю |
| б) не изменится | г) уменьшится |
2-49. Качественно определите: энтропия при протекании реакции
3Fe(Т) + 2CO(Г) = Fe3C(Т) + CO2(Г)
| а) уменьшится | в) не изменится |
| б) увеличится | г) равна нулю |
2-50. Изменение энтропии реакции:
2C4H10(Г) + 13O2(Г) = 8CO2(Г) + 10H2O(Г),
если SC4H10 = a, SO2 = b, SCO2 = c, SH2O = d, вычисляется по уравнению
| а) DS = 2a – 13b + 8c – 10d | в) DS = 8c + 10d – 2a – 13b |
| б) DS = 8c + 10d – a – 13b | г) DS = 2a + 13b – 8c – 10d |
Дата добавления: 2015-08-27; просмотров: 65 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тема 1. Классы неорганических соединений. | | | Тема 3. Химическая кинетика и равновесие. |