
|
Читайте также: |

Рівняння (4.3) називається рівнянням ізотерми хімічної реакції, або рівнянням Вант-Гоффа, яке було виведене ним у 1886 році.
В перший доданок цього рівняння входять початкові парціальні тиски реагуючих речовин, а в другий — їх рівноважні тиски.
Рівняння ізотерми характеризує зміну енергії Гіббса при одному перебігу хімічної реакції в дуже великій системі при довільно заданому співвідношенні вихідних речовин і продуктів реакції.
За рівнянням ізотерми хімічної реакції можна визначити напрямок перебігу самодовільних процесів.
Якщо 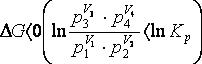 , самодовільно проходить пряма реакція, якщо
, самодовільно проходить пряма реакція, якщо  , самодовільно пройде зворотна реакція, якщо
, самодовільно пройде зворотна реакція, якщо 
, система перебуває в стані рівноваги.
Таким чином, за допомогою рівняння ізотерми можна визначити хімічну спорідненість різних речовин, тобто характеризувати їх здатність вступати в хімічну взаємодію.
Для співставлення реакційних здатностей різноманітних хімічних систем, які відрізняються за хімічною природою, було введене поняття “стандартна хімічна спорідненість” (стандартна енергія Гіббса), що характеризує реакційну здатність хімічної системи за стандартних умов. Для ідеальних газів таким стандартом є рівність одиниці вихідних парціальних тисків (концентрацій) всіх учасників реакції.
Тоді рівняння ізотерми приймає вигляд:
ΔG˚ =- RT ln Kp (4.4)
У випадку реальних газів і розчинів вихідні і рівноважні концентрації в рівняннях ізотерми замінюються активностями відповідних учасників реакції.
Стандартна енергія Гіббса — ΔG˚реагуючої хімічної системи може бути знайдена за стандартними енергіями Гіббса утворення ΔG˚f її компонентів:

Стандартною енергією Гіббса утворення називають зміну енергії Гіббса при утворенні 1 моль складної речовини з простих за стандартних умов (Т= 298 К, р = 101,325 кПа).
Для простих речовин стандартні енергії утворення дорівнюють нулю.
Стандартну енергію Гіббса для хімічних реакцій можна також розрахувати за рівнянням Гіббса—Гельмгольца (2.31).
Залежність константи рівноваги від температури. Рівняння ізохори та ізобари хімічної реакції. Рівновага у гетерогенних реакціях.
З рівняння (4.0) випливає, що константа рівноваги залежить від температури. Вираз для залежності константи рівноваги від температури можна одержати, користуючись рівнянням Гіббса— Гельмгольца: 

Підставляючи похідну, а також значення ΔG˚ з ізотерми хімічної реакції в рівняння Гіббса—Гельмгольца, маємо:
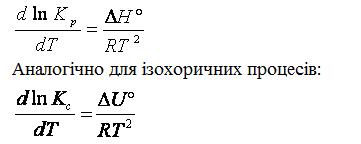
Вираз (4.6)називають рівнянням ізобари, а вираз (4.7)— рівнянням ізохори хімічної реакції. З цих рівнянь можна зробити висновок, що для екзотермічної реакції (ΔН < 0) підвищення температури зменшує константу рівноваги, тобто зменшує вміст продуктів реакції в рівноважній суміші. Отже, для екзотермічних реакцій підвищення температури невигідне. Якщо реакція ендотермічна (ΔН > 0), то при підвищенні температури константа рівноваги збільшується, тобто вміст продуктів реакції в реакційній суміші збільшується. Таким чином, підвищення температури зміщує рівновагу в бік ендотермічної реакції.
При інтегруванні рівняння ізобари (вважаючи тепловий ефект незалежним від температури) отримаємо: 
За графіком залежності lnКр від 1/T можна визначити тепловий ефект реакції як тангенс кута нахилу прямої до осі абсцис, помножений на R.
Інтегруючи в межах від Т1 до Т2, одержуємо: 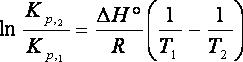
Це рівняння використовують для розрахунку Кр при будь-якій температурі Т2, якщо відома Кр при одній температурі Т1.
Дата добавления: 2015-08-17; просмотров: 665 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Правило фаз Гіббса | | | Вплив температури середовища на хімічну рівновагу |