
Читайте также:
|
Відповідно до принципу Лe Шательє, збільшення температури зсуває рівновагу у бік охолодження, тобто підсилює ту реакцію, при якій теплота поглинається. Якщо пряма реакція екзотермічна (Q > 0), то при нагріванні рівновага зсувається вліво (у бік реагентів), а якщо пряма реакція ендотермічна (Q < 0), то рівновага зсувається вправо (у бік продуктів). Зменшення температури зсуває рівновагу у бік нагрівання, тобто в напрямку екзотермічної реакції.
Реакція розкладання кальцій карбонату є ендотермічною реакцією:
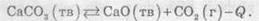
Добування кальцій оксиду (негашеного вапна) з вапняку є поширеною реакцією в промисловості, оскільки негашене вапно є важливою сировиною для виготовлення будівельних матеріалів. Оскільки теплота в результаті цієї реакції поглинається, то для зсуву рівноваги у бік продуктів необхідно температуру підвищувати. Тому розкладання вапняку проводять за високої температури.
Зверніть увагу на те, що вираз «зсув рівноваги у бік тієї або іншої реакції» означає збільшення концентрації продуктів цієї реакції в порівнянні з попереднім станом рівноваги.

Константа рівноваги залежить лише від природи реагентів і
температури. Таким чином, при сталій температурі константа рівноваги
оборотної реакції є сталою величиною, яка відображає те співвідношення між
концентраціями продуктів реакції (у чисельнику) і початкових речовин (у
знаменнику), що встановлюється при рівновазі.
Дата добавления: 2015-08-17; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Рівняння ізотерми хімічної реакції | | | Типи хімічного зв’язку в кристалічних структурах. |