
|
Читайте также: |
Розчин - це однофазна гомогенна система, яка складається з двох або більше компонентів і продуктів їх взаємодії. Розчини бувають ненаси-ченими, насиченими, перенасиченими.
Насиченим називається розчин, який знаходиться в динамічній рівно-вазі з кристалами розчиненої речовини. В ненасиченому розчині концентра-ція розчиненої речовини менша, ніж у насиченому, а в перенасиченому - бі-льша, ніж у насиченому. Перенасичені розчини є термодинамічно не стійки-ми системами.
Стан рівноваги може бути досягнутий з двох сторін – прове-денням як прямої, так і зворотної реакції. У стані рівноваги постійно перебі-гає хімічна взаємодія, однак, у при цьому швидкості прямого і зворотного процесів однакові, тому видимих змін у системі не спостерігається. Хімічна рівновага динамічна: зі зміною зовнішніх умов вона зрушується, тобто якийсь час переважно буде перебігати прямий або зворотний процес, поки не буде досягнутий стан рівноваги, що відповідає новим умовам; якщо інтенси-вність зовнішніх факторів, що впливають на сферу реакції, приймає вихідне значення, то і система повертається до вихідного стану.
Важливим для кількісного опису стану рівноваги є закон дії мас *. Сучасна формуліровка цього закону має такий вигляд:
Відношення добутку рівноважних активностей (або летючестей для га-зів) продуктів реакції, що взяті у ступенях, які дорівнюють їх стехіомет-ричним коефіцієнтам, до такого ж добутку для вихідних речовин є для даної температури постійною величиною.
Цю величину називають термодинамічною константою хімічної рів-новаги. Математичним виразом закону дії мас для деякої реакції, яку запи-шемо у загальному вигляді
a А + В b c С + D, d
є рівняння
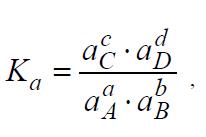
де a – рівноважні активності реагентів та продуктів реакції. У тих випадках коли замість активності компонентів можна використовувати концентрацію, застосовують константу хімічної рівноваги, що виражена через рівноважні концентрації.
Величина константи хімічної рівноваги залежить від температури. Ця залежність передається рівнянням ізобари хімічної реакції
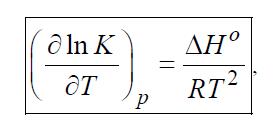
Дата добавления: 2015-08-17; просмотров: 159 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| СЕДИМЕНТАЦИЯ | | | Однокомпонентні системи |