
|
Читайте также: |
Під електрокінетичними явищами в колоїдах розуміють переміщення однієї фази відносно іншої в електричному полі. Перенесення колоїдних частинок в електричному полі називається електрофорезом, а протікання рідини через капіляри системи під впливом різниці потенціалів -
електроосмосом. Електрокінетичні явища свідчать про наявність відповідного заряду на колоїдних частинках. Розглянемо будову міцели золю йодиду срібла, одержаного при зливанні
розведених розчинів нітрату срібла і йодиду калію. Одну з реагуючих речовин взято в надлишку. На поверхні утворених агрегатів частинок AgІ переважно адсорбуються іони, які входять до складу твердої фази (Ag+ або I+). Ці іони називаються потенціалвизначальними. Агрегати частинок разом з потенціалвизначальними іонами називаються ядрами. Поверхня частинок
AgI набуває заряду і іони протилежного знаку (протиіони) притягуються до неї. Частина протиіонів міцно зв'язується з ядром електростатичними і адсорбційними силами, утворюючи адсорбційний шар протиіонів. "Решта протиіонів, внаслідок теплового руху, знаходиться на деякій відстані від твердої поверхні, утворюючи дифузійний шар протиіонів, які утримуються біля поверхні тільки електростатичними силами. На поверхні частинок утворюється подвійний електричний шар (ПЕШ). Агрегат разом з потенціалвизначальними іонами і протиіонами адсорбційного шару складає гранулу (колоїдну частинку). Колоїдні частинки мають заряд. Електронейтральна система, що складається з колоїдної частинки і протиіонів дифузійного шару, називається колоїдноюміцелою.
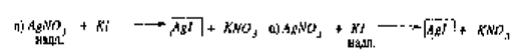

Рис. 12. Будова колоїдної міцели золю AgI, одержаної зливанням розчинів AgNO3 і КІ.
Потенціал подвійного електричного шару, який відповідає межі ковзання, називається електрокінетичним або ξ -потенціалом.
1) водный р-р - поверхность AgI. При избытке в растворе Ag+(при добавлении AgNO3) эти ионы являются потенциалоопределяющими
В роли противоионов выступают NO3-, часть которых, находится в плотном слое, часть - в диффузном.
Ф-ла ДЭС:[AgI]m · nAg+|(n - x)NO3-|x NO 3-
n-число потенциалопределяющих ионов
x-число противоионов в диффузной части
Если в систему с AgI добавить KNO3, то потенциалопределяющими станут иодид - ионы:
[AgI]m · nI-|(n - x)K+|x K+
5. Дифузія – процес самовільного вирівнювання густини (концентрації) суміші газів, рідин та, навіть, твердих тіл, тобто перенос маси.
Явище дифузії підлягає закону Фіка: маса газу, яка переноситься через одиничну площадку за одиницю часу пропорційна градієнту густини. Знак „мінус” у формулі показує, що перенесення маси спрямоване в бік зменшення густини:
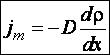

Введемо таке поняття як дифузійний потік, тобто кількість молекул речовини, які в процесі дифузії проходять за одиницю часу через одиничну площину, перпендикулярну до напрямку руху молекул. В нашому випадку  маса мічених молекул, що переноситься через площадку. Вона визначається як
маса мічених молекул, що переноситься через площадку. Вона визначається як 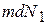 , тоді дифузійний потік молекул через площадку
, тоді дифузійний потік молекул через площадку
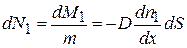 .
.
Коефіцієнтом пропорційності є величина 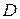 , що має назву коефіцієнта дифузії. У такому випадку коефіцієнт дифузії визначається дифузійним потоком, при одиничному градієнті концентрації.
, що має назву коефіцієнта дифузії. У такому випадку коефіцієнт дифузії визначається дифузійним потоком, при одиничному градієнті концентрації.
В системі СІ коефіцієнт дифузії має розмірність 1 м2/с.
Дата добавления: 2015-08-17; просмотров: 263 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Правила утворення золів, умови утворення нової фази. | | | БРОУНОВСКОЕ ДВИЖЕНИЕ |