
|
Читайте также: |
Изучение кинетики гетерогенного процесса цементации меди титриметрическим методом
Цель работы: определение степени превращения вещества, периода индукции реакции и эмпирической скорости реакции; нахождение кинетических параметров токохимического уравнения.
Изучение кинетики цементации меди (II) на железе (цинке) осуществляется при помощи установки, схема которой приведена на рис. 21.
 |
1 - магнитная мешалка;
2 - вертушка;
3 - стакан химический;
4 - раствор соли меди (II);
5- металлическая пластина;
6 - стеклянная ручка;
7 - штатив.
Концентрация меди в растворе определяется йодометрическим методом. В мерную колбу на 100 мл отбирают пипеткой пробу объемом 5 мл и добавляют 2 мл раствора  (10-%-ной) и доводят до метки водой. В коническую колбу отобрать 10 мл 10%-го раствора
(10-%-ной) и доводят до метки водой. В коническую колбу отобрать 10 мл 10%-го раствора 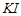 и 10 мл раствора из мерной колбы. Поставить в темное место на 10 минут. Побуревший раствор титруют тиосульфатом натрия (
и 10 мл раствора из мерной колбы. Поставить в темное место на 10 минут. Побуревший раствор титруют тиосульфатом натрия ( ) пока окраска не станет соломенно-желтой. После этого прибавляют 3 мл раствора крахмала и продолжают титровать до обесцвечивания образующегося синего раствора. Концентрацию
) пока окраска не станет соломенно-желтой. После этого прибавляют 3 мл раствора крахмала и продолжают титровать до обесцвечивания образующегося синего раствора. Концентрацию  определяют по формуле:
определяют по формуле:
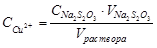 ,(89)
,(89)
где  - концентрация тиосульфата натрия, моль/л;
- концентрация тиосульфата натрия, моль/л;
 - объем тиосульфата натрия, пошедшего на титрование пробы, мл;
- объем тиосульфата натрия, пошедшего на титрование пробы, мл;
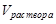 - объем пробы исследуемого раствора, мл.
- объем пробы исследуемого раствора, мл.
Порядок проведения работы.
Приборы и реактивы:
Магнитная мешалка,
Секундомер,
Стаканчики,
Конические колбы,
Бюретки 25 мл и градуированные пипетки,
Растворы соли меди (II), соляной кислоты,
Железо (или цинк),
Дистиллированная вода.
1. В стакан емкостью 250 мл наливают раствор соли меди (II) концентрацией – 0,1 моль/л, объёмом 1/2 стакана и подкисляют до pH < 2 серной кислотой (pH проверить по индикаторным полоскам). Химический стакан с раствором ставится на магнитную мешалку.
2. Первая проба исследуемого раствора отбирается перед погружением пластины в раствор. Концентрация меди в растворе определяется йодометрическим методом. В мерный стакан на 100 мл отбирают пипеткой пробу объёмом 5 мл и добавляют 1 мл  (10%-ной) и доводят до метки дистиллированной водой.
(10%-ной) и доводят до метки дистиллированной водой.
В коническую колбу отобрать пипеткой 10 мл раствора из мерного стакана и отмерить цилиндром 10-15 мл 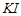 (20%-ного). Полученный раствор поставить в тёмное место на 10 минут. После этого в колбу добавить 2-3 капли крахмала из стакана и титровать 0,005 моль/л раствором
(20%-ного). Полученный раствор поставить в тёмное место на 10 минут. После этого в колбу добавить 2-3 капли крахмала из стакана и титровать 0,005 моль/л раствором  до обесцвечивания синего цвета. Концентрацию
до обесцвечивания синего цвета. Концентрацию  определяют по формуле:
определяют по формуле:
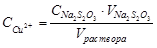 ,
,
где  - концентрация тиосульфата натрия, моль/л;
- концентрация тиосульфата натрия, моль/л;
 - объем тиосульфата натрия, пошедшего на титрование пробы, мл;
- объем тиосульфата натрия, пошедшего на титрование пробы, мл;
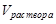 - объем пробы исследуемого раствора, мл.
- объем пробы исследуемого раствора, мл.
3. Металлическая пластина за стеклянную ручку крепится в лапке штатива, опускается в раствор соли меди (II) и включается магнитная мешалка.
4. Последующие пробы отбираются через 3 минуты и анализируются, как описано в пункте 2. Всего исследуют 8-10 проб.
5. Концентрацию меди (II) в данный момент времени рассчитанную по формуле (89) заносят в таблицу 15.
Таблица 11.
| № пробы | Время отбора пробы | Время от начала реакции  , мин , мин
|  ,мл ,мл
|  ,моль/л ,моль/л
| 
| 
| lg[-lg(1-a)] | 
| 
| 
| |
6. Степень превращения меди рассчитывают по формуле:
 ,(90)
,(90)
где  - начальная концентрация меди (II) в растворе;
- начальная концентрация меди (II) в растворе;
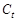 - концентрация меди в растворе к моменту времени
- концентрация меди в растворе к моменту времени  .
.
7. По полученным результатам постройте кинетическую кривую в координатах  и
и  .
.
8. Для нахождения кинетических параметров ( и
и  ) в топохимическом уравнении Ерофеева - Колмогорова строят график в координатах:
) в топохимическом уравнении Ерофеева - Колмогорова строят график в координатах:
 (91)
(91)
в соответствии с уравнением 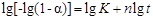 . По тангенсу угла наклона прямой определяют показатель
. По тангенсу угла наклона прямой определяют показатель  , а затем рассчитывают константу скорости
, а затем рассчитывают константу скорости  по уравнению (65).
по уравнению (65).
Контрольные вопросы.
1. Какие реакции называются гетерогенными?
2. Основные стадии гетерогенных процессов?
3. Сделайте анализ кинетической зависимости  и изменения скорости реакции во времени?
и изменения скорости реакции во времени?
4. Запишите уравнение Ерофеева - Колмогорова.
Дата добавления: 2015-08-10; просмотров: 108 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная работа № 4. | | | Изучение кинетики термического разложения |