
Читайте также:
|
Скорость большинства химических реакций с повышением температуры резко возрастает. Эта зависимость для гомогенной реакции приближённо описывается элементарным правилом Вант-Гоффа: при нагревании на 10 градусов константа скорости увеличивается в 2-4 раза, т.е.
 ,(39)
,(39)
где  - константа скорости при температуре
- константа скорости при температуре  ;
;
 - константа скорости при температуре
- константа скорости при температуре 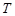 .
.
Соотношение  называется температурным коэффициентом и обозначается
называется температурным коэффициентом и обозначается  . Определив
. Определив  , можно приближённо рассчитать константу скорости при любой температуре по уравнению:
, можно приближённо рассчитать константу скорости при любой температуре по уравнению:
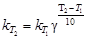 (40)
(40)
(в небольшом интервале относительно невысоких температур).
Более точно зависимость скорости реакции от температуры описывается уравнением Аррениуса:
 ,(41)
,(41)
где  - константа скорости реакции;
- константа скорости реакции;
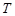 - температура, К;
- температура, К;
 - универсальная газовая постоянная;
- универсальная газовая постоянная;
 - эмпирическая постоянная, имеющая размерность энергии (энергия активации). После интегрирования уравнения принимает вид:
- эмпирическая постоянная, имеющая размерность энергии (энергия активации). После интегрирования уравнения принимает вид:
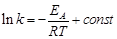 ,(42)
,(42)
а в экспоненциальной форме:
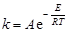 ,(43)
,(43)
где 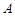 - эмпирическая постоянная, называемая предэкспоненциальным м жителем и численно равная константе скорости при
- эмпирическая постоянная, называемая предэкспоненциальным м жителем и численно равная константе скорости при  .
.
Энергией активации реакции согласно теории соударений называется минимальная энергия (в расчёте на 1 моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к взаимодействию. Частицы, энергия которых больше или равна  , называются активными.
, называются активными.
Дата добавления: 2015-08-10; просмотров: 63 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ И ПОРЯДКА РЕАКЦИИ. | | | ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КАТАЛИЗАТОРА. (ГОМОГЕННЫЙ КАТАЛИЗ). |