
При гетерогенном катализе катализатор представляет собой поверхность твёрдого тела, а реагирующие вещества могут находиться в газовой фазе или в растворе.
Механизм гетерогенного катализа в принципе не отличается от гомогенного катализа. Атомы или группы атомов на поверхности твёрдого катализатора образуют с реагирующими веществами активные комплексы или неустойчивые промежуточные соединения. Благодаря этому снижается энергия активации и реакция ускоряется. Однако теория гетерогенного катализа сложнее, чем теория гомогенного катализа. Это объясняется тем, что нужно учитывать адсорбцию реагирующих веществ на поверхности твёрдого тела. Адсорбцией называется поглощение (сгущение) вещества на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы - адсорбатом. Активированная адсорбция или хемосорбция, обусловлена проявлением химических, валентных сил между адсорбированными молекулами и атомами поверхности твёрдого тела.
Любая гетерогенно-каталитическая реакция, протекающая в присутствии твёрдого катализатора, включает ряд стадий:
- массоперенос исходных веществ путём диффузии из объёма газовой или жидкой фазы к внешней поверхности катализатора;
- адсорбция реагентов на поверхности катализатора;
- химическая реакция на поверхности с участием одной или нескольких хемсорбированных частиц;
- десорбция продуктов реакции с освобождением поверхности катализатора;
- массоперенос продуктов реакции в объёме жидкой или газовой фазы (диффузия).
В зависимости от условий протекания процесса и его особенностей наиболее медленной может быть любая из пяти стадий, а, следовательно, и скорость каталитического процесса может лимитироваться одной из них. Для сравнительной оценки активности катализаторов определяющей является скорость реакции на поверхности. Поэтому в тех случаях, когда важно получить значение активности катализатора, стараются процесс вести таким образом, чтобы скорость его определялась кинетической стадией.
Скорость гетерогенно-каталитической реакции равна количеству вещества, реагирующего на единице поверхности катализатора за единицу времени:
 (67)
(67)
и зависит от степени заполнения поверхности молекулами реагентов. Согласно закону «действующих поверхностей» для молекулярной реакции  , протекающей на поверхности катализатора:
, протекающей на поверхности катализатора:
 .(68)
.(68)
Для бимолекулярной реакции  если молекулы
если молекулы 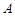 и
и  реагируют между собой в адсорбированном состоянии скорость реакции на поверхности равна:
реагируют между собой в адсорбированном состоянии скорость реакции на поверхности равна:
 ,(69)
,(69)
где  - степень заполнения поверхности данным реагентом.
- степень заполнения поверхности данным реагентом.
Если все места на поверхности твердого тела, на которых может происходить хемосорбция (активные центры), энергетически равноценны, между частицами отсутствует взаимодействие и на одно место приходиться одна частица, то уравнение изотермы адсорбции имеет вид:
 ;(70)
;(70)
где  - степень заполнения поверхности;
- степень заполнения поверхности;
 - максимальное количество вещества, которое может адсорбироваться на данной поверхности (при
- максимальное количество вещества, которое может адсорбироваться на данной поверхности (при  = 1);
= 1);
 - константа адсорбционного равновесия;
- константа адсорбционного равновесия;
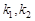 - константы скорости адсорбции и десорбции.
- константы скорости адсорбции и десорбции.
Уравнение (70) называется уравнением Ленгмюра. Поскольку обычно гетерогенно-каталитические реакции протекают в стационарном режиме, то сумма скоростей стадий приводящих к образованию и расходованию промежуточных веществ, равна нулю
 ,(71)
,(71)
где  - стехиометрический коэффициент
- стехиометрический коэффициент 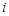 -го промежуточного вещества в s-стадии;
-го промежуточного вещества в s-стадии;
 - скорость этой стадии.
- скорость этой стадии.
Уравнение (71) - уравнение стационарной каталитической реакции. При протекании каталитической реакции устанавливается некоторая стационарная степень заполнения поверхности молекулами реагентов и продуктов реакции. При этом
 (72)
(72)
где 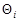 - доля занятых активных центров;
- доля занятых активных центров;
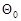 - доля свободных активных центров.
- доля свободных активных центров.
С помощью уравнений (68) - (72) может быть получено кинетическое уравнение каталитической реакции, если известен её механизм. Так как обычно механизм реакции неизвестен, то для объяснения кинетических закономерностей той или иной реакции пользуются обобщёнными схемами. И в настоящее время можно говорить только о наличии нескольких теорий, в первом приближении обобщающих те или иные экспериментальные данные.
Дата добавления: 2015-08-10; просмотров: 104 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КИНЕТИКА ТОПОХИМИЧЕСКИХ РЕАКЦИЙ. | | | ЗАКЛЮЧЕНИЕ. |