
Читайте также:
|
Теоретическое изучение сложных реакций основывается на положении о независимости протекания элементарных реакций. Согласно этому положению при протекании в системе одновременно нескольких реакций каждая из них идёт независимо от других и подчиняется закону действия масс (принцип независимости).
В обратимых реакциях скорости прямой и обратной реакции соизмеримы. Простейшей обратимой реакцией (двусторонней) является обратимая реакция первого порядка. Примерами могут служить процессы взаимного превращения изомеров-цис-транс-изомеризация или изомеризация цианида аммония в карбамид;  . Схематически такая реакция может быть представлена уравнением:
. Схематически такая реакция может быть представлена уравнением:
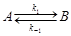
Кинетические кривые для такого типа реакций приведены на рис. 1

Рис.1. Кинетические кривые для обратимой реакции первого порядка:
1 - прямая реакция;
2 - обратная реакция.
Наблюдаемая скорость здесь определяется разностью скоростей прямой и обратной реакций:  , а дифференциальное уравнение скорости имеет вид:
, а дифференциальное уравнение скорости имеет вид:
 .(23)
.(23)
Для состояния равновесия  и, следовательно, первое слагаемое в скобке
и, следовательно, первое слагаемое в скобке 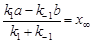 , где
, где 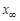 - изменение концентрации, соответствующее равновесию. Таким образом, получим
- изменение концентрации, соответствующее равновесию. Таким образом, получим  .
.
После интегрирования
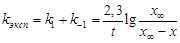 .(24)
.(24)
В то же время, в условиях равновесия, когда 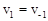 и
и 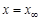
 ,(25)
,(25)
где 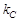 - константа равновесия, выраженная через концентрации. Уравнения (24) и (25) дают возможность рассчитать обе константы скорости
- константа равновесия, выраженная через концентрации. Уравнения (24) и (25) дают возможность рассчитать обе константы скорости  и
и  . Из выражения (25) видно, что константа равновесия представляет собой соотношение констант скоростей прямой и обратной реакций.
. Из выражения (25) видно, что константа равновесия представляет собой соотношение констант скоростей прямой и обратной реакций.
Изолированные реакции - реакции, в ходе которых образуется продукт только одного типа.
Параллельные реакции - такие, в которых взятые вещества одновременно реагируют в двух или более направлениях (в результате образуются разные продукты). Так, при хлорировании бензола получаются одновременно три изомера двузамещённых бензола: орто-, мета-, и пара- хлорбензол. Схематическая запись простейшей реакции этого типа:

Вещественно А участвует одновременно в двух реакциях первого порядка с образованием продуктов В и С. Наблюдаемая скорость реакции (скорость расходования исходных веществ) равна сумме скоростей параллельных реакций:
 .
.
Обозначив через  - исходную концентрацию вещества А; через
- исходную концентрацию вещества А; через  -убыль его концентрации к моменту времени
-убыль его концентрации к моменту времени  , а через
, а через  и
и  -концентрации продуктов В и С (
-концентрации продуктов В и С (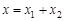 ) можно выразить скорость реакции в виде:
) можно выразить скорость реакции в виде:
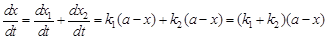 .(26)
.(26)
После интегрирования:
 .(27)
.(27)
Каждую из констант скоростей находим по соотношению концентраций продуктов:
 .(28)
.(28)
Кинетические кривые для такой простейшей параллельной реакции приведены на рис. 2.
 |
1 - убыль А в реакции (1);
2 - убыль А в реакции (2);
3 - суммарная убыль А в параллельных реакциях (1) и (2).
Последовательные (многоступенчатые, или консекутивные) реакции.
К таким реакциям относятся реакции с промежуточными стадиями. Промежуточными продуктами в них могут быть обычные молекулы, вступающие далее в реакцию, или свободные радикалы или атомы. Большинство химических реакций протекают именно по такому пути. В простейшем случае это две последовательные односторонние реакции первого порядка, например термический крекинг нефти, где бензин является промежуточным продуктом, распадающимся далее на газообразные вещества.
Уравнение простейшей последовательной реакции:
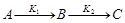
Скорость накопления промежуточного вещества  будет
будет  , а концентрацию этого вещества рассчитывают по уравнению:
, а концентрацию этого вещества рассчитывают по уравнению:
 ,(29)
,(29)
где  - начальная концентрация вещества
- начальная концентрация вещества 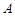 . Концентрацию конечного продукта
. Концентрацию конечного продукта 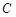 вычисляют по уравнению:
вычисляют по уравнению:
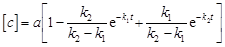 .(30)
.(30)
На рис. 3. приведены кривые изменения во времени количеств веществ 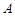 ,
,  ,
, 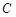 (
( ,
, 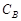 ,
,  ). Чем меньше
). Чем меньше  , тем выше лежит максимум кривой для вещества
, тем выше лежит максимум кривой для вещества  и тем дальше он от момента начала реакции. В начале реакции вещество
и тем дальше он от момента начала реакции. В начале реакции вещество 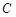 вообще нельзя обнаружить. Это - скрытый период, называемый периодом индукции
вообще нельзя обнаружить. Это - скрытый период, называемый периодом индукции  :
:
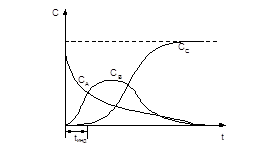 |
Рис. 3. Изменение концентраций веществ в ходе последовательной реакции с необходимыми элементарными стадиями при  .
.
Многие реакции протекают в несколько последовательных и параллельных стадиях. Кинетический расчёт таких реакций очень сложен. В химической кинетике широко используется ещё один приближённый метод - метод стационарных концентраций (стационарного состояния). Этот метод применим к системам последовательных и последовательно-параллельных реакций, если промежуточные продукты в них характеризуются высокой реакционной способностью. Предполагается, что концентрация промежуточных соединений, находящихся в системе в незначительных количествах по сравнению с исходными веществами и продуктами реакции, не изменяется в ходе реакции. Вначале равная нулю концентрация быстро достигает постоянного (стационарного) значения на всём протяжении процесса. Такой режим процесса называется стационарным. Скорость изменения концентрации промежуточных частиц здесь остаётся равной нулю, а это позволяет заменить для них дифференциальные уравнения алгебраическими. Тогда весь комплекс дифференциальных уравнений при описании кинетически сложного химического процесса упрощается.
Сопряжённые реакции. Это - система как минимум двух протекающих одновременно в одной фазе реакций, из которых одна зависит от другой. Такие реакции часто протекают в растворах и весьма распространены в живых организмах. Наиболее изученными являются реакции окисления. Например, окисление  и бензола пероксидом водорода. Сульфат железа (II) окисляется независимо от присутствия бензола (первичная реакция), но бензол окисляется лишь в присутствии
и бензола пероксидом водорода. Сульфат железа (II) окисляется независимо от присутствия бензола (первичная реакция), но бензол окисляется лишь в присутствии  . Причина здесь в образовании общего промежуточного продукта, связывающего оба процесса, - радикала
. Причина здесь в образовании общего промежуточного продукта, связывающего оба процесса, - радикала  .
.
Таким образом, это совместные реакции вида:
 первичная реакция (1)
первичная реакция (1)
 вторичная реакция (2)
вторичная реакция (2)
Реакция (2) осуществляется лишь при протекании реакции (1), т.е. при условии, если взяты вещества 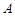 ,
,  и
и 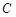 . Вещество
. Вещество  , необходимое для возбуждения реакции (2), является её индуктором (
, необходимое для возбуждения реакции (2), является её индуктором (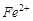 ) вещество
) вещество 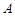 , общее для обеих реакций, называется актором (
, общее для обеих реакций, называется актором ( ). Вещество
). Вещество 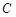 , трудноокисляемое, вовлекается в реакцию под действием индуктора и называется акцептором (
, трудноокисляемое, вовлекается в реакцию под действием индуктора и называется акцептором (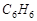 ). Сопряжение реакций возможно, если промежуточное вещество реакции (1) является исходным в реакции (2), т.е. связывает оба процесса (
). Сопряжение реакций возможно, если промежуточное вещество реакции (1) является исходным в реакции (2), т.е. связывает оба процесса ( ). Такое явление передачи реакционной способности от одной реакции к другой называется химической индукцией. В сопряжённых реакциях индуктор расходуется и не регенерируется.
). Такое явление передачи реакционной способности от одной реакции к другой называется химической индукцией. В сопряжённых реакциях индуктор расходуется и не регенерируется.
Дата добавления: 2015-08-10; просмотров: 98 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ. | | | ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ И ПОРЯДКА РЕАКЦИИ. |