
Читайте также:
|
Гетерогенные процессы это процессы, протекающие на границе раздела двух сред. Примерами гетерогенных процессов могут служить процессы растворения, кристаллизации, испарения, конденсации, химическая реакция на границе двух фаз, электрохимические процессы на границе электрод - раствор электролита и гетерогенный катализ.
Гетерогенный процесс состоит из нескольких стадий: доставки вещества из раствора к поверхности твёрдого тела, химической реакции на поверхности твёрдого тела и отвода продуктов реакции от поверхности в глубь раствора. Могут быть и другие стадии: ассоциация или диссоциация молекул исходного вещества в растворе дополнительные химические превращения продукта реакции у поверхности твёрдого тела: рекомбинация, димеризация, протонизация и т.д. Каждая из этих стадий может быть лимитирующей, т.е. иметь самую малую константу скорости и оказывать наибольшее сопротивление процессу.
Доставка вещества к границе между фазами может осуществляться за счёт конвекции и диффузии. Конвекцией называется перемещение всей среды в целом. Диффузией называется перемещение вещества в неподвижной среде под влиянием градиента концентрации. Скоростью диффузии называется количество вещества, проходящее через данное поперечное сечение в единицу времени. Количественная закономерность диффузии описывается двумя уравнениями Фика. Согласно первому закону Фика скорость диффузии  - пропорциональна площади
- пропорциональна площади 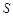 поперечного сечения и градиенту концентрации
поперечного сечения и градиенту концентрации 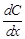 :
:
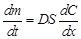 ,(45)
,(45)
где 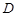 - коэффициент пропорциональности, называемый коэффициентом диффузии; м2/с.
- коэффициент пропорциональности, называемый коэффициентом диффузии; м2/с.
Коэффициент диффузии равен скорости диффузии через сечение, равное 1 м2 при градиенте концентрации равном 1 моль/м2.
В уравнении (45) предполагается, что вещество диффундирует в направлении, противоположном направлению оси х, поэтому производная 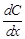 положительна.
положительна.
Второе уравнение Фика можно вывести, если рассмотреть два поперечных сечения 1 м2 на расстоянии  друг от друга. Если скорость диффузии через первое сечение равна
друг от друга. Если скорость диффузии через первое сечение равна  , то через второе сечение на расстоянии
, то через второе сечение на расстоянии  (по направлению диффузии вещества) она равна:
(по направлению диффузии вещества) она равна:
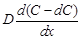 .
.
Расстояние  частица пройдёт за время
частица пройдёт за время  .
.
Тогда изменение концентрации вещества в элементе объёмом 1  м3 в единицу времени равно:
м3 в единицу времени равно:
 (46)
(46)
или
 .(47)
.(47)
Выражение (47) называется вторым уравнением Фика. Задавая начальные и граничные условия, можно путём интегрирования второго уравнения Фика получить выражение для скорости гетерогенного процесса, лимитируемого процессом диффузии.
Различают диффузию линейную и пространственную; бесконечную и ограниченную; стационарную и нестационарную. Линейная диффузия происходит в одном направлении, пространственная - в разных направлениях. Диффузия называется бесконечной, если фронт диффузии в процессе гетерогенной реакции не успевает достигнуть границы системы; диффузия является ограниченной, если она достигает границы системы. Под фронтом диффузии понимается граница внутри раствора, где не заметны изменения в концентрации, вызванные процессом диффузии. При стационарной диффузии концентрация вещества в любой данной точке пространства не меняется со временем; при нестационарной - меняется. Рассмотрим нестационарную линейную полубесконечную диффузию, когда вещество диффундирует вдоль длинной цилиндрической трубки, а реагирующей твёрдой поверхностью является дно этого цилиндра. В начальный момент времени, когда реакция на поверхности ещё не началась, концентрация вещества вблизи поверхности  равна концентрации
равна концентрации  в объёме раствора:
в объёме раствора:  и
и 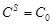 (начальное условие). Если реакция на поверхности протекает очень быстро, то в любой момент времени после начала процесса концентрация у поверхности практически равна нулю:
(начальное условие). Если реакция на поверхности протекает очень быстро, то в любой момент времени после начала процесса концентрация у поверхности практически равна нулю:  и
и  (первое граничное условие). При полубесконечной диффузии концентрация в глубине раствора должна оставаться постоянной:
(первое граничное условие). При полубесконечной диффузии концентрация в глубине раствора должна оставаться постоянной:  и
и 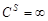 и
и 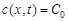 (второе граничное условие). Решая второе уравнение Фика (47) при этих условиях и считая, что скорость гетерогенного процесса лимитируемого процессом диффузии в соответствии с первым уравнением Фика (45) описывается выражением (на единицу времени):
(второе граничное условие). Решая второе уравнение Фика (47) при этих условиях и считая, что скорость гетерогенного процесса лимитируемого процессом диффузии в соответствии с первым уравнением Фика (45) описывается выражением (на единицу времени):
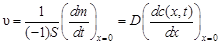 .(48)
.(48)
Получим уравнение Коттреля:
 .(49)
.(49)
При нестационарной сферической полубесконечной диффузии, когда реагирующей твёрдой поверхностью является сфера, скорость гетерогенного процесса может быть представлена уравнением:
 ,(50)
,(50)
где  - радиус сферы.
- радиус сферы.
Гетерогенные процессы при стационарной конвективной диффузии осуществляемые в перемешиваемых растворах. Согласно законам гидродинамики поток жидкости вблизи поверхности твёрдого тела тормозится, причем слой жидкости (эффективный диффузионный слой толщиной  ), непосредственно прилегающий к поверхности, прочно удерживается на ней и не перемещается относительно неё. Условие стационарности при линейной диффузии записывается как
), непосредственно прилегающий к поверхности, прочно удерживается на ней и не перемещается относительно неё. Условие стационарности при линейной диффузии записывается как  , при этом второй закон Фика принимает вид
, при этом второй закон Фика принимает вид
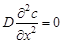 и
и 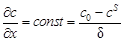 .(51)
.(51)
Подставляя уравнение (51) в (45) получаем для скорости процесса, лимитируемого процессом диффузии:
 ;(52)
;(52)
 ,(53)
,(53)
где 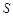 - поверхность твёрдого тела, на которой протекает гетерогенная реакция;
- поверхность твёрдого тела, на которой протекает гетерогенная реакция;  - коэффициент массопередачи;
- коэффициент массопередачи; 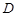 - коэффициент диффузии.
- коэффициент диффузии.
Если реакция на поверхности протекает очень быстро, то можно принять  . При этом получаем из уравнения (52):
. При этом получаем из уравнения (52):
 .(54)
.(54)
Как видно в этом случае скорость стационарного процесса лимитируется диффузией и подчиняется уравнению первого порядка. Подставляя 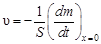 и
и  в (54) разделяя переменные и интегрируя от
в (54) разделяя переменные и интегрируя от 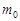 до
до  и от 0 до
и от 0 до  , получим:
, получим:
 ,(55)
,(55)
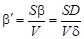 ,(56)
,(56)
где 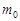 и
и  - количество вещества в растворе соответственно в начальный момент времени(
- количество вещества в растворе соответственно в начальный момент времени( ) и через время
) и через время  протекания стационарного гетерогенного процесса;
протекания стационарного гетерогенного процесса;  - объём раствора.
- объём раствора.
По уравнению (55) можно вычислить количество вещества прореагировавшего на границе сред за время  :
:
 .(57)
.(57)
При растворении твёрдого тела в перемешиваемом растворе у поверхности твёрдого тела поддерживается концентрация 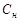 насыщенного раствора, а внутри раствора концентрация равна
насыщенного раствора, а внутри раствора концентрация равна  . Скорость растворения твёрдого тела в соответствии с уравнением (52) равна:
. Скорость растворения твёрдого тела в соответствии с уравнением (52) равна:
 .(58)
.(58)
При  это уравнение имеет вид
это уравнение имеет вид  . Этому уравнению подчиняется также стационарные процессы растворения газа в перемешиваемой жидкости, если доставка газа из газовой фазы к поверхности жидкости не лимитирует процесс.
. Этому уравнению подчиняется также стационарные процессы растворения газа в перемешиваемой жидкости, если доставка газа из газовой фазы к поверхности жидкости не лимитирует процесс.
При повышении температуры лимитирующая стадия и соответственно механизм гетерогенного процесса могут изменяться. Это связано с разным характером зависимости константы скорости ( ) химической реакции и коэффициента массопереноса
) химической реакции и коэффициента массопереноса 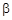 от температуры, т.е. от их температурных коэффициентов. Константа скорости химической реакции в соответствии с уравнением Аррениуса имеет вид:
от температуры, т.е. от их температурных коэффициентов. Константа скорости химической реакции в соответствии с уравнением Аррениуса имеет вид:
 или
или  ,
,
где  - энергия активации гетерогенной реакции.
- энергия активации гетерогенной реакции.
Зависимость коэффициента массопереноса от температуры определяется выражением:
 (59)
(59)
или 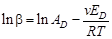 ,(60)
,(60)
где 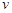 - показатель степени, с которым коэффициент диффузии входит в выражение для скорости процесса диффузии;
- показатель степени, с которым коэффициент диффузии входит в выражение для скорости процесса диффузии;
 - энергия активации для скорости процесса диффузии.
- энергия активации для скорости процесса диффузии.
Если при низкой температуре лимитирующей стадией гетерогенного процесса является химическая реакция - кинетическая область гетерогенного процесса. При повышении температуры константа скорости химического процесса быстро увеличивается (в 2-4 раза на 10 К) и, начиная с некоторой температуры, когда константа скорости  химической реакции сделается больше
химической реакции сделается больше 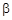 , лимитирующей стадией становится диффузионный процесс диффузионная область гетерогенного процесса. При этом происходит постепенный переход из кинетической области в диффузионную и изменение углового коэффициента прямой на графике
, лимитирующей стадией становится диффузионный процесс диффузионная область гетерогенного процесса. При этом происходит постепенный переход из кинетической области в диффузионную и изменение углового коэффициента прямой на графике  (рис. 7.) от
(рис. 7.) от  (прямая АВ) до
(прямая АВ) до  (прямая CD).
(прямая CD).

Рис.7. Влияние температуры на константу скорости гетерогенного процесса.
АВ - кинетическая область;
ВС - промежуточная область;
CD - диффузионная область;
По величине углового коэффициента можно судить о механизме гетерогенного процесса. Если энергия активации, определяемая из углового коэффициента, равна 5-20 кДж/моль, то процесс диффузионный. Если энергия активации равна 50-200 кДж/моль, то процесс кинетический. В промежуточной области(кривая СВ) гетерогенный процесс контролируется как диффузией, так и химическим процессом на границе фаз.
Дата добавления: 2015-08-10; просмотров: 445 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КАТАЛИЗАТОРА. (ГОМОГЕННЫЙ КАТАЛИЗ). | | | КИНЕТИКА ТОПОХИМИЧЕСКИХ РЕАКЦИЙ. |