
Читайте также:
|
Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного при электролизе на количественное окисление или восстановление анализируемого вещества.
Метод использует объединённый закон Фарадея:

где:
- m - масса определяемого вещества, г;
- М - молярная масса определяемого вещества, г/моль;
- Q - количество электричества, Кл (Ф);
- F - число Фарадея, 96493 Кл моль -1;
- n - число электронов, участвующих в реакции.
По способу выполнения различают прямую и косвенную кулонометрию, по технике выполнения – потенциостатическую (Е = const) и амперостатическую (I = const).
Методы прямой и косвенной кулонометрии отличаются по аппаратурному оформлению и технике определения. Прямую кулонометрию обычно проводят при контролируемом потенциале, косвенную – при постоянном значении тока.
Прямая кулонометрия используется в основном в потенциостатическом режиме для определения электроактивных веществ (тяжёлых металлов или анионов), и непосредственно подвергающихся электролизу на одном из электродов. Устанавливают на рабочем электроде потенциал разложения Еразл анализируемого вещества и поддерживают его постоянным. В процессе электролиза концентрация электроактивного вещества и ток в цепи экспоненциально убывают во времени.
Зависимость выражается уравнением:
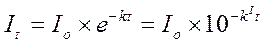 ;
;
где: It - ток в момент времени t;
I0 - ток в момент начала электролиза;
k - константа, зависящая от площади поверхности электрода, коэффициента диффузии вещества, объёма раствора, толщины диффузного слоя;
Электролиз ведут до остаточного тока 0,01% (погрешность 1%) или 0,001% (погрешность 0,1%).
Количество электричества определяют интегрированием
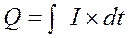
Дата добавления: 2015-07-21; просмотров: 52 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Потенциометрия. | | | Методы определения количества электричества |