
Читайте также:
|
После поглощения кванта ультрафиолетового излучения часть ароматических аминокислот (и их остатков в белках) фотоионизируется. При этом формируется катион-радикал соответствующей аминокислоты и свободный электрон. В водной среде свободный электрон быстро окружается ориентированными молекулами растворителя, формирующими вокруг него сольватационную оболочку. Эта оболочка тормозит взаимодействие электрона с молекулами объекта, увеличивая время его пребывания в свободном виде. Такой электрон, окруженный сольватационной оболочкой, принято называть сольватированным. Ход событий, следующих за поглощением кванта излучения ароматической аминокислотой (тирозином, триптофаном или фенилаланином), может, таким образом, описан следующим уравнением:
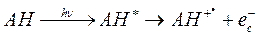
В замороженных образцах, при температуре жидкого азота (-196о С), появление сольватированных электронов в растворах ароматических аминокислот при их УФ облучении может быть обнаружено по появлению фиолетовой окраски. Эта окраска связана с тем, что сольватированные электроны обладают способностью к поглощению света, а максимум в их спектре поглощения приходится на 600 нм. Сольватированные электроны могут также быть выявлены с помощью ЭПР.
Интересно, что при освещении замороженных облученных растворов ароматических аминокислот красным излучением (вблизи 600 нм) наблюдается обратная фотоионизации фотохимическая реакция:
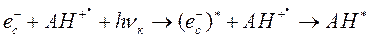
Как видно из приведенного уравнения, при обратной реакции часть получившихся в результате нее молекул аминокислоты пребывает в электронно-возбужденном состоянии. Как следствие, в таких случаях при освещении замороженного образца красным излучением можно наблюдать его свечение в синефиолетовой и ультрафиолетовой областях спектра (соответствующее фосфо- и флуоресценции изучаемой ароматической аминокислоты):
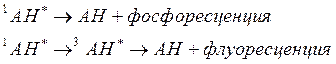
Указанное явление получило название индуцированной светом люминесценции.
При достаточно высокой температуре сольватированный электрон может разрушить и за счет тепловой энергии. Следующая за этим обратная рекомбинация свободных электронов и катион-радикалов ароматических аминокислот приводит к появлению триплетно-возбужденных молекул. Часть таких молекул затем высвечивает кванты фосфоресценции. В результате нагревание ранее охлажденного облученного УФ излучением раствора ароматической аминокислоты приводит к его свечению, которое соответствует спектру фосфоресценции изучаемой аминокислоты и носит название термолюминесценция:
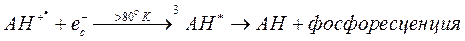
Из написанного выше видно, что генерируемые после поглощения кванта ультрафиолетового излучения фотофизические и фотохимические сдвиги в молекулах ароматических аминокислот в принципе обратимы. Если бы все первичные фотопродукты этих аминокислот всегда рекомбинировали, никаких необратимых фотопревращений не наблюдалось бы. Но это не так. Значительная часть сольватированных электронов и катион-радикалов аминокислот не рекомбинирует, а вступает в другие реакции.
В частности, известно, что катион-радикал ароматической амнокислоты сам является очень сильной кислотой и при температурах от 77 до 140о К легко диссоциирует с высвобождением протона и формированием нейтрального радикала:
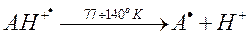
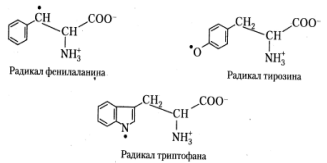
На основании анализа спектров фотолюминесценции и возбуждения фотолюминесценции продуктов фотолиза ароматических аминокислот в различных условиях постулировано существование следующих форм их нейтральных радикалов:
В отличие от нейтральных радикалов тирозина и фенилаланина, нейтральный радикал триптофана весьма нестабилен и быстро меняет свою структуру с формированием соединения следующего типа:
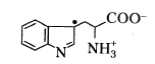
Неспаренный электрон в этом соединении локализован на 3-м углеродном атоме индольного кольца.
Вообще говоря, все нейтральные радикалы ароматических аминокислот – очень нестабильные и химически активные соединения. При температурах выше 160-200о К эти радикалы активно вступают в дальнейшие взаимодействия. Эти взаимодействия можно условно разделить на 2 типа: протекающие в присутствии кислорода и не требующие его участия.
В присутствии кислорода наблюдается фотоокисление ароматических аминокислот, которое, вероятно, протекает следующим образом:
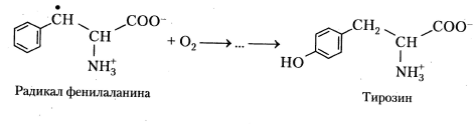
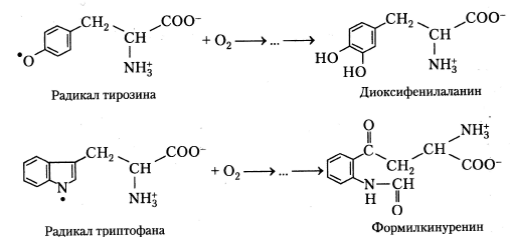
Хотя подробно механизмы взаимодействия между нейтральными радикалами аминокислот и конечными продуктами их фотоокисления еще не изучены, изучение кинетик хемилюминесценции облученных аминокислотных растворов показывает, что, скорее всего, процесс протекает через стадию формирования перекисей:
|
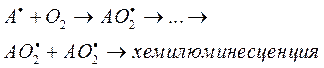
Значительный вклад в фотохимическую модификацию белковых молекул вносят реакции с участием сольватированного электрона. Особенно чувствительны к его действию остатки цистина и цистеина. Взаимодействие выбитых из остатков ароматических аминокислот сольватированных электронов с данными остатками приводит к их быстрому разрушению:
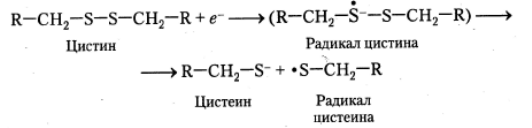
Рекомбинация радикалов цистеина приводит к формированию цистина:
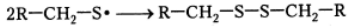
Если же в системе имеется кислород, цистеиновые радикалы могут взаимодействовать и с ним, формируя цистеинсульфоновую кислоту:
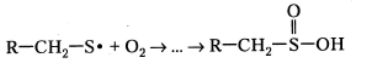
Сольватированные электроны могут также вступать во взаимодействие с некоторыми алифатическими аминокислотными остатками, например, с остатком глицина, хотя этот процесс протекает существенно менее эффективно, чем разрушение под их влиянием цистина и цистеина:
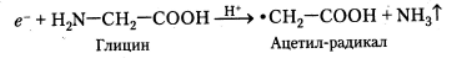
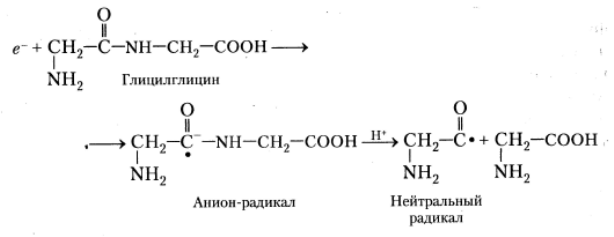
Наконец, в присутствии алифатических дипептидов (например, глицил-глицина) фотоионизация ароматических аминокислотных остатков может привести к появлению анион-радикалов пептидных групп. Дальнейшие превращения этих радикалов заканчиваются разрушением пептидных связей следующим путём:
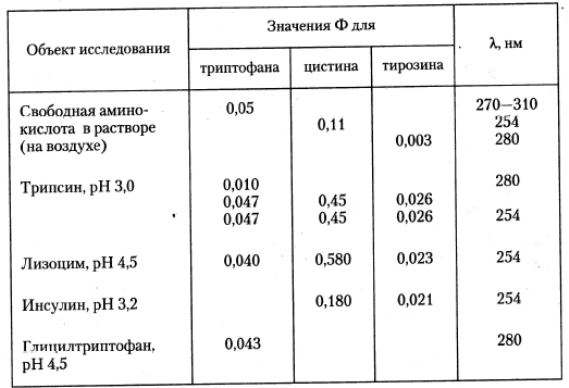
В заключение этого раздела приведем величины квантовых выходов (j) фоторазрушения ряда аминокислот и аминокислотных (табл. 5) и общую схему процессов, сопровождающих фотохимическую модификацию белковых молекул.
Таблица 5. Квантовые выходы ( j ) фотолиза для некоторых аминокислот и их остатков составе белков.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 131.

|
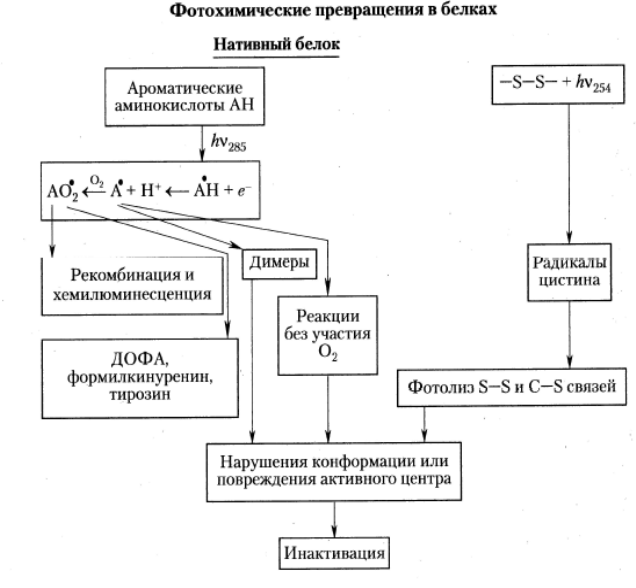
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 132.
Дата добавления: 2015-07-25; просмотров: 176 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Кинетика фотоинактивации белковых молекул. | | | Действие ультрафиолетового излучения на биологические мембраны. |