
Читайте также:
|
Воздействие УФ излучения на белковые молекулы чаще всего приводит к их денатурации и утрате ими физиологических функций. Лишь в редких случаях воздействие излучения сопровождается стимуляцией активности белков. Примерами белков, подверженных такой активации, могут быть супероксиддисмутаза, карбоксипептидаза А, гемоглобин.
Но наиболее часто встречающийся и наиболее хорошо исследованный результат воздействия УФ излучения на молекулы протеинов – их фотоинактивация. Для однокомпонентных белков фотоинактивация протекает, как правило, по однофотонному (одноударному) механизму. Дозовая зависимость такого процесса носит экспоненциальный характер и может быть описана формулой:
|
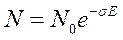
В этом выражении N – концентрация активных молекул белка в образце (выраженная в числе молекул в 1 мл) после облучения, N0 – их концентрация до воздействия излучения, s - поперечное сечение фотоинактивации данного протеина (равное произведению поперечного сечения поглощения его молекул r на квантовый выход фотоинактивации j), E – доза облучения образца, выраженная в числе квантов.
Величины квантовых выходов фотоинактивации у большинства белковых молекул относительно невелики (j =0,0005¸0,05). Конкретное значение этого показателя определяется типом инактивируемого протеина.
Фотоинактивация белков является следствием фотохимического разрушения аминокислотных остатков в их полипептидных цепях. Наибольшее значение для фотоинактивации белков имеет фотолиз остатков цистина, триптофана и тирозина. Для разрушения каждого из указанных аминокислотных остатков достаточно поглощения им одного фотона излучения.
Рассматривая процесс фотоинактивации какого-либо протеина следует иметь в виду следующее:
Те аминокислотные остатки в молекуле белка, фотохимическое разрушение которых приводит к утрате белковой молекулой функциональной активности, принято называть существенными для фотоинактивации данного протеина.
Обозначим количество существенных для фотоинактивации аминокислотных остатков в исследуемом белке как n. Понятно, что величина n может быть от 0 до m (общего числа аминокислотных остатков в полипептидной цепи данного белка). Количественно кинетика фотолиза i -го существенного аминокислотного остатка в нативном белке (при небольшой оптической плотности облучаемого образца) описывается выражением:
|
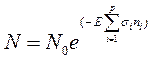
При этом суммарное поперечное сечение фотоинактивации белка будет связана с si для i -го существенного аминокислотного следующим образом:
|
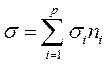
При облучении белка излучением с длинами волн свыше 240 нм, где отсутствует поглощение у пептидных связей и алифатических аминокислотных остатков, фотоинактивация протеина будет связана с фоторазрушением остатков цистина (точнее, S-S групп), тирозина и триптофана. Поэтому уравнение (139) может быть переписано в следующем виде:
|
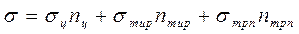
Суммарное поперечное сечение фотоинактивации исследуемого белка s можно определить из дозовой зависимости этого процесса. Из соответствующих дозовых зависимостей можно определить также величины sц, sтир и sтрп . Поскольку фотоинактивация протеина происходит вследствие фотолиза только существенных аминокислотных остатков, далее интересно бывает определить величины nц, nтир и nтрп. Для этого исследуется фотоинактивация белка при облучении таким монохроматическим излучением, поглощение которого остатками цистина, тирозина и триптофана максимально различается. Например, можно последовательно исследовать фотоинактивацию протеина при действии на него УФ излучением с длинами волны 254, 280 и 289 нм. Для всех трех длин волн действующего излучения определяются s, sц, sтир и sтрп. Зная эти величины, можно написать следующую систему уравнений:
|
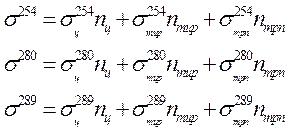
В системе уравнений (141) неизвестны только nц, nтир и nтрп. Соответственно, имеется однозначное решение, и искомые величины nц, nтир и nтрп могут быть определены. С помощью подобного приема были установлены следующие интересные факты:
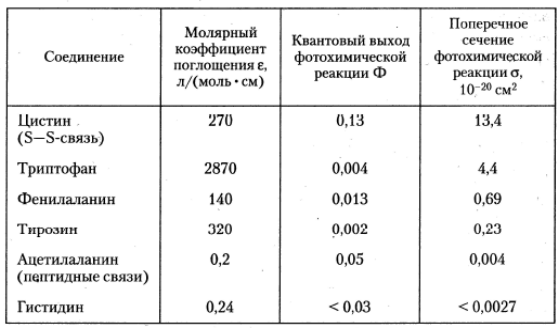
Из сказанного выше вытекает, что значимость в процессе фотоинактивации белков разных аминокислотных остатков меняется в зависимости от спектрального состава действующего на протеин УФ излучения. При действии излучения с l >285 нм основной вклад в фотоинактивацию вносят остатки триптофана и тирозина, тогда как при действии на белок более коротковолнового излучения возрастает роль фотолиза цистиновых остатков (S-S -связей). Значения молярных коэффициентов поглощения, квантовых выходов и поперечного сечения их фотолиза для ряда аминокислот приведены в табл. 4.
Таблица 4. Фотохимическая чувствительность аминокислот при действии УФ излучения с длиной волны 254 нм.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 126.
|
Дата добавления: 2015-07-25; просмотров: 145 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Естественное (солнечное) ультрафиолетовое излучение. | | | Природа первичных продуктов фотолиза аминокислот и их остатков в белках. |