
Читайте также:
|
По сравнению с s-металлами рассматриваемые р-М являются и кинетически, и термодинамически менее активными из-за более прочной связи валентных электронов с ядром, а также (как следствие) большей прочности решетки их простых веществ (судя по значениям т.пл. данных р-металлов в сравнении с s-М).
Однако восстановительные свойства для них очень характерны: (Е0(Pb2+/Pb)= –0,13 В; Е0(Sn2+/Sn)= –0,14 В), особенно для алюминия (Е0(Al3+/Al)= –1,68 В). Он является непосредственным соседом (в периодической таблице) очень активного магния и во многом на него похож, в частности, тоже горит в СО2:
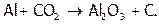
Причина – образование очень прочных связей в Al2O3. Вследствие чего алюминий, как и Mg, вытесняет не только углерод, но и металлы из их оксидов[37]. Например:
 .
.
По той же причине и горит Al на воздухе с огромным экзоэффектом (–1676 кДж/моль), причем ослепительным пламенем, почти как Mg. Поэтому алюминиевую фольгу (как и магниевую) используют для фотовспышек.
Хотя и очень медленно, но окисление алюминия на воздухе продолжается и после образования такой пленки. То есть со временем она утолщается – вот почему новая посуда из Al, такая блестящая вначале, потом тускнеет.
Тем не менее в промышленности все чаще изделия из железа, чтобы спасти их от коррозии[38] (ржавления), алитируют, т.е. покрывают слоем алюминия (толщиной всего 0,2 мм). Покрытие осуществляют, нанося порошок Al на поверхность железного изделия, которое затем нагревают до 1000°С.
Не подвергается коррозии также олово и свинец, и тоже из-за поверхностной пленки продуктов взаимодействия с компонентами воздуха. Поэтому лудят, т.е. покрывают оловом жесть, используемую в консервной промышленности.
Подчеркнем, что оксидная пленка не мешает алюминию при об.у. реагировать со всеми Г2 (давая AlГ3). Правда, к смеси порошков Al и йода, чтобы реакция началась, добавляют каплю воды. Со всеми другими неметаллами алюминий вступает в реакцию при повышенной температуре. Олово и свинец более пассивны: при об.у. идет лишь взаимодействие Pb с F2, а остальные реакции требуют нагревания. При этом олово окисляется до +4, а свинец до +2.
С водой данные металлы при об.у. не реагируют, но и не должны, т.к. значения их Е0 менее отрицательны, чем потенциал воды (Е0(Н2О/Н2)= –0,41 В). А алюминий должен, но тоже не взаимодействует из-за оксидной пленки.
Однако Al, а также Sn и Pb вступают в реакцию с водой в щелочной среде, поскольку их оксиды и гидроксиды (которые обычно пассивируют данные металлы), являясь амфотерными, растворяются в щелочах, давая гидроксоанионы. (А устойчивость последних столь велика, что значения Е0 даже олова и свинца оказываются отрицательнее, чем Е0 воды в щелочной среде (–0,82 В).) Суммарные процессы отражаются реакциями:
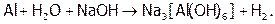
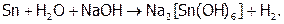
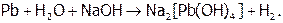
Отметим, что при сплавлении металлов с сухой щелочью получаются не гидроксо-, а оксосоли, причем окисление идет кислородом воздуха. Например:

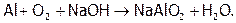
Подчеркнем, что при действии конц. HNO3 и H2SO4 пассивирующая пленка на поверхности алюминия не только не растворяется, а наоборот утолщается (с 0,01 до 30 микрон), и глубже процесс не идет, поэтому данные кислоты можно хранить в алюминиевой таре.
Напротив, с разб. HNO3, HCl и H2SO4 алюминий реагирует. А свинец в двух последних кислотах пассивируется пленками малорастворимых солей PbCl2 и PbSO4. Зато свинец взаимодействует даже с уксусной кислотой, а также с HNO3 и с концентрированными HCl и H2SO4, поскольку при этом получаются растворимые продукты: Pb(CH3COO)2, Pb(NO3)2, H2[PbCl4] и Pb(HSO4)2 соответственно. Олово вступает в реакцию со всеми кислотами, кроме слабых (например, таких, как уксусная).
Дата добавления: 2015-07-25; просмотров: 52 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Физические свойства | | | Оксиды и соли p-элементов |