
|
Читайте также: |
1. Составьте электронные формулы атомов следующих элементов: азота, неона, кремния, кальция, титана, хрома, меди, селена, платины, самария,свинца., радона. 7N 10Ne 14Si
20Ca 22Ti 24Cr
29Cu 34Se
78Pt 62Sm
82Pb 86Rn
2. Составьтеэлектронные формулы и распределите электроны по квантовым ячейкам для атомов следующих элементов: углерода, фосфора, хлора,определив их валентность.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ.
Электроотрицательность - это способность атома в молекуле притягивать к себе электроны.
Таблица 3
Относительная электроотрицательность элементов (по Полингу)
| H -2,1 | ||||||
| Li – 1,0 | Be –1,5 | B –2,0 | C-2,5 | N –3,0 | O –3,5 | F –4,0 |
| Na –0,9 | Mg -1,2 | Al –1,5 | Si –1,8 | P –2,19 | S -2,5 | Cl -3,0 |
| K –0,8 | Ca –1,0 | Sc –1,3 | Ge -1,7 | As -2,18 | Se -2,4 | Br –2,8 |
| Rb –0,8 | Sr -1,0 | Y –1,3 | Sn –1,7 | Sb –1,8 | Te –2,1 | J –2,5 |
| Cs –0,7 | Ba –0,9 | La-1.0 | Pb –1,6 | Bi –1,6 | Po –2,0 | At –2,2 |
Упражнение.
Рассчитайте, как изменится разность ЭО для молекул ряда HF-HCl-JCl-HJ
На основании рассчета сделайте вывод об изменении в этом ряду полярности и прочности молекул.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ.
1. Ковалентная связь – связь, осуществляемая парой электронов, принадлежащих обоим атомам.
Неполярная Полярная
Н2 Н × + × Н ® Н: Н НСl Н × + × Сl: ® Н:Сl:
2. Ионная связь - связь, осуществляемая за счет электростатического притяжения между противоположно зарядными ионами (между катионом и анионом). Электронная пара полностью принадлежит одному из атомов.
Na× + ×Cl: ® [Na]+ + [:Cl:]- ® [Na]+[Cl]-
3. Донорно-акцепторная (координационная) связь - ковалентная связь, осуществляемая за счет пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
:NH3+€H+ ® € [NH4]+
H é H ù+
H:N: +€H+ ®€ H:N:H
H ë H û Металлическая связь - связь, обусловленная наличием валентных электронов,обладающих большой свободой движения в кристаллической решетке,образуемой положительными ионами металла.
4 .Водородная связь – связь между водородом и наиболее
 |
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ (ВС).
Этот метод описывает образование химической связи в молекуле за счет перекрывания АО валентных электронов атомов, участвующих в образовании связи. Если в образовании связи участвует одна пара электронов – связь простая, если несколько – кратная.
HCl (простая связь) N2 (кратная связь)
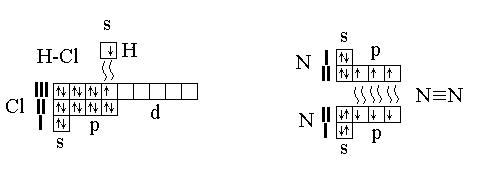
Составление графических формул.
В графических формулах каждая валентность изображается черточкой.
Например:
Аl(ОH)3 НNО3 КМn04




 O-H O O
O-H O O


 Al O-H H-O-N K-O-Mn O
Al O-H H-O-N K-O-Mn O




 O-H O O
O-H O O
P2O5 Mn2O7
O O O O











 P – O – P O Mn – O – Mn O
P – O – P O Mn – O – Mn O







 O O O O
O O O O
Упражнения.
1.Определите тип химической связи в молекулах следующих соединений: Cl2, O2, H2O, NH3, HF, NaCl, NH4Cl.
2.Объясните образование химической связи в молекулах F2, H2S, CO2, BeCl2, BF3, CH4 по методу валентных связей.
3. Составьте графические форлулы молекул следующих соединений:
H2SO4, H3PO4, Na2CO3, NaHSO3, Al2(SO4)3
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными о/в реакциями называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Окислитель – вещество, принимающее электроны.
Восстановитель – вещество, отдающее электроны.
Окислительные свойства проявляют атомы, находящиеся в своих соединениях в высшей степени окисления. Восстановительные свойства проявляют атомы, находящиеся в своих соединениях в низшей степени окисления. Окислительно-воосстановительные свойства могут проявлять атомы, находящиеся в своих соединениях в промежуточной (между высшей и низшей) степени окисления.
Для всех элементов высшая степень окисления равна номеру группы, в которой он находится в ПСЭ. Для неметаллов низшая степень окисления равна номеру группы, в которой находится элемент в ПСЭ минус 8, для металлов низшая степень окисления равна нулю.
Продукты, которые получаются в результате о/в реакции, можно предсказать исходя из:
- из возможных степеней окисления атома в соединении, играющем роль окислителя или восстановителя в о/в реакции;
- -из условий протекания о/в реакции (среды, концентрации, температуры);
- -из значений стандартных о/в потенциалов.
При определении продуктов о/в реакций, предлагаемых к рассмотрению в этом журнале, удобно использовать приведенные ниже таблицы.
Таблица 4.
Важнейшие восстановители.
| Восстановленная форма | Окисленная форма |
| Na2SO3 KNO2 H2S (K2S) HCl (H гал) KJ FeSO4 KСrO2 | Na2SO4 KNO3 S Cl2 (гал2) J2 Fe2(SO4)3 K2CrO4 |
Таблица 5
Важнейшие окислители.
 Окислитель Среда Окислитель Среда
| Восстановленная форма |
| KMnO4 Н2SO4 KMnO4 H2O KMnO4 KOH K2Cr2O7 H2SO4 K2Cr2O7 HCl K2CrO4 KOH | MnSO4 бесцветный MnO2 бурый K2MnO зеленый Cr2(SO4)3 фиолет. CrCl3 фиолет. KСrO2 зеленый |
При определении возможного взаимодействия металлов с кислотами, не обладающими окислительными свойствами (соляной, уксусной, разбавленной серной и др.), следует обращаться к ряду напряжения металлов. Однако следует помнить, что большинство металлов, в том числе и неактивные (в ряду напряжения стоят за водородом), взаимодействуют с кислотами-окислителями (азотной, концентрированной серной и др.). Продуктами восстановления этих кислот никогда не является водород.
Продукты окисления металлов азотной и серной кислотами, а также продукты восстановления этих кислот сведены в таблице 6.
Таблица 6
Взаимодействие металлов с серной и азотной кислотами.
| Кислота | Активные металлы (Li-Zn) | Малоактив-ные металлы (Sn,Pb) | Пассивиру-ющиеся мет.(Co,Fe,Al,Ni) | Неактив- ные мет. (Cu-Ag) |
| H2SO4 разб. | Соль + H2 | Соль + H2 | Соль + H2 | _______ |
| H2SO4 конц. | Соль + S, H2S + H2O | H2[Pb(SO4)2] СольSn2+ + SO2 + H2O | Me2O3 + SO2 + H2O | Соль + SO2 + H2O |
| HNO3 конц. | Соль + NO + H2O | СольPв2+, Н2SnO3 +NO2 + H2O | Me2O3 +NO2 + H2O | Соль+NO2 +H2O |
| HNO3 разб. | Соль +N2, N2O+H2O | Соль Ме(II)+NO2 + H2O | Соль + NO+H2O, cольСо(II), Fe(II), Ni(II) | Соль+NO2 +H2O |
| HNO3 оч.разб. | Соль+ NH4NO3+ H20 | __________ | ______________ | ________ |
Для подбора коэффициентов в уравнениях о/в реакций
ранее Вы использовали метод составления электронного баланса. Однако его следует использовать только для реакций,, протекающих в твердой, газообразной или смешанной твердо-газовой фазе. Если о/в реакция протекает в водном растворе, Вы должны пользоваться электронно-ионным методом, т.к. молекулы многих окислителей и восстановителей, являясь сильными электролитами, в воде находятся в виде ионов.
Таблица 7.
Электронно-ионный метод.
| Среда | Окислитель | Восстановитель |
| Кислая рН>7 | Ни справа, ни слева не должно быть ионов ОН- | |
| MnO4- +8H++5ē= Mn2++4H2O H2O2 +2H++2ē=2H2O | SO3- +H2O -2ē = SO42-+2H+ H2O2 -2ē=O2 +2H+ | |
| Щелочная pH<7 | Ни справа, ни слева не должно быть ионов Н+ | |
| ClO3-+3H2O +6ē=Cl-+6OH- H2O2+2ē =2OH- | SnO22-+ 2OH--2ē=SnO32-+H2O H2O2+2OH--2ē=O2 +2H2O | |
| Нейтральная pH»7 | Слева –только Н2О, справа-то, что нужно для баланса: Н+ или ОН- | |
| MnO4- +2H2O+3ē=MnO2+4OH- H2O2+2ē =2OH- | NO2+H2O -2ē =NO3- =2H+ H2O2-2ē=O2 +2H+ |
УПРАЖНЕНИЯ.
Закончите уравнения реакций и подберите к ним коэффициенты с помощью электронно-ионного баланса:
1. KMnO4 + HCl =
2. K2Cr2O7 + H2S + H2SO4 =
3. KMnO4 + FeSO4 + H2SO4 =
4. Br2 + NaOH = NaBr + NaBrO3 + H2O
5. K3AsO3 + Zn + HCl =AsH3 +
6. P + HNO3 + H2O = H3PO4 + NO
7. KCrO2 + Br2 + KOH =
8. Cu2O + HNO3 =
9. K2Cr2O7 + H2O2 + H2SO4 =
10. Sn + HNO3 = H2SnO3¯ +NO2 + Н2O
Дата добавления: 2015-07-25; просмотров: 208 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Из этого принципа следует, что при увеличении давления | | | ХИМИЯ ЭЛЕМЕНТОВ. |