
Читайте также:
|
равновесие смещается в сторону той реакции, которая сопровождается уменьшением числа молей газообразных веществ, а при уменьшении давления - в сторону реакции, сопровождающейся увеличением числа молей газообразных веществ.
При увеличении температуры равновесие смещается в сторону реакци, идущей с поглощением тепла (эндотермической), при уменьшении температуры – в сторону реакции, идущей с выделением тепла (экзотермической).
Опыт 2. Смещение химического равновесия вследствие изменения концентрации реагирующих веществ.
FeCl3 + 3 KSCN «Fe(SCN)3 + 3KCl
 K=
K=
Результаты опыта:
| № пробирки | Увеличение концентрации | Изменение окраски | Смещение равновесия |
| Эталон | |||
| KSCN | |||
| FeCl3 | |||
| KCl |
Примечание: В присутствии избытка роданид-ионов образуются, кроме того, ионы {Fe(SCN)6}3-, что приводит к образованию красной окраски даже при ничтожно малых концентрациях ионов Fe3+.
Упражнения:
1. Во сколько раз увеличится скорость реакции при повышении температуры от 30 до 50о, если температурный коэффициент равен 3?: а) в 6 раз; б) в 9 раз; в) в 12 раз (подчеркните)
2. В какую сторону сместится равновесие реакции
4NH3 (г)+ 3O2 (г)«2N2(г)+ 6 H2O(г)
при увеличении давления?: а) вправо; б) влево; в) не сместится (подчеркните).
3. Составьте выражение закона действующих масс и констант химического равновесия для систем:
а) CaCO3 «CaO + CO2
б) 2С + О2 «2СО
РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ИОННЫЕ РЕАКЦИИ ОБМЕНА.
Распад молекул электролитов на ионы под действием полярных молекул растворителя (например, воды) называется электролитической диссоциацией.
Вспомните и напишите определение понятия «степень диссоциации» и классификацию «электролитов», исходя из ее значения.
Степень диссоциации a это-
Сильные электролиты, a>____________
1. Почти все растворимые соли.
2. Многие минеральные кислоты (H2SO4, HNO3, HCl, HBr,HJ,HMnO4, HClO4 и др.).
3. Основания щелочных и щелочноземельных металлов (NaOH, KOH, Ca(OH)2, Ba(OH)2).
Слабые электролиты, a <_______________ 
1. Почти все органические кислоты (CH3COOH, C2H5COOH),
некоторые минеральные кислоты (H2CO3, H2S, H2SiO3, H3BO3,
HCN и др.).
2. Гидроксиды металлов (кроме гидроксидов щелочных и щелочно-земельных металлов), гидроксид аммония.
3. Вода.
4. Нерастворимые в воде соли.
Иногда отдельно выделяют группу электролитов средней силы,____>a>____(например: HNO2, H2SO3).
Константа равновесия процесса диссоциации электролита на ионы называетя константой диссоциации (или ионизации)- Кд.
По ее значению, приведенному в справочнике, можно определить «силу» электролита, а именно:
сильные электролиты Кд³ 10-2
слабые электролиты Кд < 10-4
электролиты средней силы 10-2 >Кд>10-4
Диссоциация кислот:
(определите по Кд, к электролитам какой силы они относятся?)
H2SO4 = H+ + НSO41-
НSO41- = Н+ + SO42- К2 = 1,15 ×10-2_______электролит
1стадия: H3PO4 «H+ + H2PO4- К1 = 7,1× 10-3электролит______
2 стадия: H2PO4-«H+ + HPO42- К2 = 6,2 ××10 -8_____электролит
3 стадия: HPO42--«H+ + PO43- К3 = 5,0 ×10-13_____электролит
Диссоциация оснований:
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
Диссоциация амфотерных электролитов:
Zn2+ + 2 OH- «Zn(OH)2 = H2ZnО2 «2H+ + ZnO22-
Al3++3OH-«Al(OH)3=H3AlO3®НAlO2+Н2О«Н++AlO2-+Н2O
по основному типу по кислотному типу
Диссоциация солей:
Средние соли: Fe2(SO4)3 = 2Fe3+ +3SO42-
Кислые соли: KHCO3 = K+ + HCO3-
Основные соли (в растворе): (ZnOH)2SO4 = 2ZnOH+ +SO42-
Условия необратимости ионных реакций обмена:
1) образование малорастворимых веществ;
2) образование газообразных веществ;
3) образование слабодиссоциирующих веществ.
При составлении ионных уравнений вещества молекулы слабых электролитов, электролитов средней силы и неэлектролитов (например, молекулы газов и оксидов) изображаются в виде молекул, а сильные электролиты записываются в виде ионов.
Примеры составления ионных уравнений реакций обмена:
1) 2FeCl3 + 3 H2S = ¯Fe2S3 + 6 HCl;
2Fe3+ + 3 H2S = Fe2S3 + 6H+
2) (NH4)2S + H2SO4 = (NH4)2SO4 + H2S
S2- + 2H+ = H2S
3) NH4Cl + KOH = KCl + NH4OH;
NH4+ + OH- = NH4OH
Таблица 1
Названия наиболее распространенных солей по международной (латинской) нуменклатуре.
| Название кислоты | Формула | Название средних солей |
| Азотная Азотистая Серная Сернистая Сероводородная Угольная Соляная Хлорная Хлорноватая Хлористая Хлорноватистая Уксусная Хромовая Двухромовая Фосфорная Марганцовая Кремневая Иодистоводородная | HNO3 HNO2 H2SO4 H2SO3 H2S H2CO3 HCl НClO4 HClO3 HClO2 HClO CH3COOH H2CrO4 H2Cr2O7 H3PO4 HMnO4 H2SiO3 HJ | нитраты нитриты сульфаты сульфиты сульфиды карбонаты хлориды перхлораты хлораты хлориты гипохлориты ацетаты хроматы дихроматы фосфаты перманганаты силикаты иодиды |
Опыт 1. Реакции с образованием осадков.
а) CaCl2 + (NH4)2CO3 =
б) K2CrO4 + BaCl2 =
Опыт 2. Реакции с образованием газов.
а) Na2S + HCl =
б) NH4CI + NаОН =
Опыт 3. Реакции с образованием слабого электролита.
СНзСООNа + HCI =
Опыт 4. Влияние реакции среды на равновесие диссоциации амфотерного элеетролита. К I мл раствора ZnSO4 добавляют 1-2 капли раствора NаОН.
ZnSO4 + NaOH =
Полученный осадок делят на 2 части. К одной части добавляют избыток раствора HCI, к другой - избыток раствора NаОН.
Zn(OH)2 + HCl =
Zn(OH)2 + NaOH =
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ.
ПРАВИЛА ОБРАЗОВАНИЯ И РАСТВОРЕНИЯ ОСАДКОВ.
Произведение концентрации ионов малорастворимого электролита, содержащихся в его насыщенном растворе, называется произведением растворимости (ПР)(при данной температуре величина постоянная).
ПР-это константа равновесия процесса диссоциации малорастворимого электролита:
AgCl «Ag+ + Cl- ПРAgCl= [Ag+]× [Cl-]
Ca3(PO4)2 «3Ca2+ + 2PO43- ПР = [Ca2+]3× [PO43-]2
Осадок из раствора выпадает в том случае, когда произведение концентрации его ионов в растворе превышает значение произведения растворимости (например, [Ag+]× [Cl-]> ПРAgCl)
Растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР.
Для растворения осадка нужно добавить электролит, ионы которого связывают один из посылаемых осадком в раствор ионов в молекулы слабго электролита..
Опыт 5. Образование и растворение осадка.
а) сливают по I мл растворов MgSO4 и NаОН.
MgSO4 + NаОН =
К полученному осадку добавляют избыток раствора HCI.
Mg(OH)2 + HCI =
Вывод: растворение осадка ______происходит за счет связывания ионов____ в молекулу слабого электролита ____
Опыт 6. Образование наиболее прочных малорастворимых соединений:
а) сливают по I мл растворов Pb(NO3)2 и NaCl
Pb(NO3)2 + NaCl =
б) к полученному осадку добавляют I мл раствораK2CrO4
PbCl2 + K2CrO4 =

 = 2 ×10-5
= 2 ×10-5 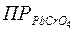 = 1,8 ×10-14
= 1,8 ×10-14
Вывод: Образование хромата свинца происходит потому,что хромат свинца _________устойчивое соединение, чем хлорид свинца, что следует из сопоставления значений их ПР.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
Ионное произведение воды: КW= [ H+] × [OH--] = 10-14
В нейтральной среде [ H+] = [OH-] = 10-7 моль/л
В кислой среде [ H+] > 10-7 моль/л (10-6,10-5)
В щелочной среде [ H+] <10-7моль/л (10-8,10-9)

Водородный показатель рН =- lg [ H+]; рОН = - lg [OH]
в нейтральной среде рН=7
в щелочной среде рН>7
в кислой среде рН<7
pH + pOH = 14
Качественно реакцию среды измеряют при помощи индикаторов (веществ, изменяющих окраску в зависимости от величины рН раствора).
Опыт 7. Определение реакции среды при помощи индикаторов.
| Индикатор | Окраска в среде | Интервал pH | ||
| Кислой pH<7 | нейтраль- ной pH=7 | щелочной pH>7 | ||
| Метилоранж Фенолфталеин | 3,1 - 4,0 8,2 - 10,0 |
ГИДРОЛИЗ СОЛЕЙ.
Взаимодействие соли с водой, приводящее к образованию слабодиссоциирующих или малорастворимых продуктов, называется гидролизом. В результате этой реакции изменяется реакция (рН) среды.
Гидролизу подвергаются соли, образованные:
1) слабой кислотой и сильным основанием (рН>7)
2) слабым основанием и сильной кислотой (рН< 7)
3) cлабой кислотой и слабым основанием (рН  @ 7).
@ 7).
В скобках указана рН водных растворов таких солей
Уравнения гидролиза солей представлены в таблице 2.
Таблица 2
Соли, подвергающиеся гидролизу
| Тип соли по катиону и аниону | Продукты гидролиза | Примеры реакций гидролиза | ||
| Сильное основание и слабая кислота рН > 7 | Слабое основание и сильная кислота рН < 7 | Слабое основание и слабая кислота рН = 7 | ||
| 1.однозаряд ный катион | Основание + кислота | NaCN+H2O= NaOH+HCN CN-+H2O= OH-+HCN | NH4Cl+H2O= NH4OH+HCl NH4++H2O= NH4OH+H+ | NH4NO2+H2O= NH4OH+HNO2 NH4++H2O= NH4OH+HNO2 |
| 2.многозарядный анион | Основание + кислая соль | Na2CO3+H2O= NaOH+NaHCO3 CO32-+H2O= HCO3-+OH- | (NH4)2SO4+H2O=NH4OH+ NH4HSO4 NH4++SO42+H2O = NH4OH+HSO4- | (NH4)2CO3+ H2O= NH4OH+NH4HCO3-NH4++CO32-+H2O= NH4OH+HCO3- |
| 3.многозарядный катион | Основная соль + кислота | Ba(CN)2+H2O= BaOHCN+HCN Ba2++CN-H2O=BaOH- +HCN | CuCl2+H2O= CuOHCl+HCl Cu2++H2O= CuOH++H+ | Al(CH3COO)3 +H2O= AlOH(CH3COO)2+ +CH3COOH Al3++CH3COOH-+H2O=AlOH2++ +CH3COOH |
| 4.многозарядный катион и анион | Этот случай практически редко встречается т.к. относящиеся сюда соли в воде нерастворимы. Для растворимых: 2CaS + 2H2O = Ca(OH)2 + Ca(HS)2 S2_ + H2O = HS- + OH- | Fe2(SO4)3+ 2H2O= FeOHSO4+ H2SO4 Fe3++H2O= FeOH2++H+ | необратимый гидролиз, основание (осн.соль)+газ Cr2S3++6H2O= 2Cr(OH)3++3H2S |
*Соли,образованные в результате обменной реакции между водными растворами некоторых солей, которые невозможно получить из водных растворов из-за необратимого гидролиза.
Гидролизу не подвергаются соли, образованные сильной кислотой и сильным основанием (KCl, Ca(NO3)2, Na2SO4, BaCl2, и др.)
Для большинства солей гидролиз является обратимым процессом.
Необратимому гидролизу подвергаются сульфиды и карбонаты некоторых металлов, Подробнее о солях, подвергающихся необратимому гидролизу, Вы узнаете в методических указаниях к контрольным заданиям (изд. № 1044).
8. Опыт Гидролиз солей
В пробирку в каждом случае наливают несколько мл раствора соли и добавляют соответствующий индикатор.
а).Соль сильного основания и сильной кислоты
NaCl + H2O «
Изменение цвета лакмусовой бумажки
Реакция среды ______________рН__________
б).Соль сильного основания и слабой кислоты:
СН3СООNa + H2O «
Изменение цвета фенолфталеина:______________________
Реакция среды ____________рН___
в).Соль слабого основания и сильной кислоты
ZnCl2 + H2O «
Изменение цвета метилового оранжевого:________________
Реакция среды _____________рН________________.
г) Соль слабого основания и слабой кислоты
СН3СООNН4 + H2O «
Изменение цвета лакмусововой бумажки____________
Реакция среды___________рН ____
Опыт 9. Необратимый гидролиз
В пробирку сливают по 1 мл растворов Al2 (SO4)3 и Nа2СО3
|
Al2(СО3)3 + Н2О =
_________________________________________________
Al2(SO4)3 + Nа2СО3 + H2O =
Наблюдения и вывод:_____________________________________
Упражнения.
1. Напишите уравнения диссоциации на ионы в растворе следующих соединений:и назовите их: H2SO3, Ba(OH)2 KH2PO4, NаНS, CrOHSO4 СиОНNО3
2. Составьте молекулярные и ионные уравнения реакций, происходящих между следующими соединениями.
Аl(ОН)з+НСl =
Сг(OH)3 + KOH =
NaHСОз + NaOH =
ZnOHCI + HCI =
Na3PO4 + H2SO4 =
ZnS + HCl =
3. Вычислите рН раствора, если [OH-] = 10-4 моль/л.
4. рН раствора равен 3. Что надо прибавить к раствору, чтобы увеличить рН до 7? а) кислоту, б) воду, в) щелочь (подчеркните).
5. Какая из приведенных солей не подвергается гидролизу? а)CaCl2, б) СH3СООNH4 в) NаСl (подчеркнуть).
6 Какая реакция среды будет при растворении в воде Ni(NO3)2?
а) кислая, б) нейтральная, в) щелочная (подчеркните).
7. Какая из приведенных солей при гидролизе по первой ступени образует кислую соль? а) NH4CI, б) (NH4)2S, в) FeSO4 (подчеркните).
8. Составьте молекулярные и ионные уравнения реакций гидролиза солей: Cr2(SO4)3, K3PO4, NH4Cl.
СТРОЕНИЕ АТОМА. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ.
Строение атома.
Химические свойства веществ зависят от строения атомов, их составляющих, в том числе и от электронной конфигурации этих атомов. Так что же такое, электронная конфигурация атома? Для ответа на этот вопрос поговорим сначала о «месте пребывания» электрона в атоме.
. Область пространства, на которой вероятность обнаружить электрон максимальна, называется атомной орбиталью (АО).. Пространство может быть описано тремя параметрами. АО описывают три квантовых числа: главное –n, орбитальное –l, магнитное -ml. На плоскости АО – квантовую ячейку изображают в виде квадрата ‹, а электроны – в виде стрелок ¯.
Главное квантовое число (n) характеризует оболочку,ее энергию - энергетический уровень, на котором находится электрон. Количество энергетических уровней в атоме соответствует номеру периода, в котором находится элемент в ПСЭ.
Орбитальное квантовое число(l) характеризует подоболочку, ее энергию - энергетический подуровень, на котором находится электрон, и форму АО. Электронные подоболочки получили обозначения по типам соответствующих им линий в атомных спектрах, а именно: s (l=0), p (l=1), d(l=2), f(l=3).
Магнитное квантовое число (ml) определяет количество способов ориентации подоболочек в магнитном поле ядра. В подоболочке с орбитальным квантовым числом l содержится 2l+1 орбиталей,т.к.
ml=2l+1. Следовательно для s, p,d, f подоболочек ml сответственно равно 1,3, 5, 7.
Вращение электрона по своей собственной «орбите» характеризует спиновое квантовое число (ms). Оно может принимать только два значения. Поэтому в каждой квантовой ячейке может находиться не более двух электронов.
Запись распределения электронов в его атоме по оболочкам, подоболочкам и орбиталям называют электронной конфигурацией или электронной формулой атома.
Основная (невозбужденная) электронная конфигурация атома определяется в результате последовательного применения трех правил: принципа Паули, принципа наименьшей энергии и правила Хунда. Вспомните и запишите в журнал эти правила.
Принцип наименьшей энергии
Принцип Паули
Правило Хунда
Примеры составления электронных формул атомов (в основном состоянии):
S - элементы (главные подгруппы I и ll групп):
iH 1s1
ll Na 1s22s22p63s1
р - элементы (главные подгруппы Ш - VШ групп):
6С 1s22s22p2
8О 1s22s22p4
35Br 1s22s2 2p63s23p63d104s24p5
d- элементы (побочные подгруппы):
23V 1s22s22p63s23p63d34s2
25Mn 1s22s22p63s23p63d54s2
27Co 1s22s22p63s23p63d74s2
f- элементы (лантаноиды и актиноиды):
58Ce 1s22s2 2p63s23p63d104s24p64d104f25s25p66s2
61Pm 1s22s2 2p63s23p63d104s24p64d104f55s25p66s2
94Pu 1s22s22p63s23p63d104s24p64d104f145s25p65d105f66s26p67s2
Поглощая энергию, атом переходит из основного состояния с минимумом энергии в одно из возбужденных.
Возбуждение атома - это разъединение спаренных электронов под воздейсвием добавочной энергии, то есть распад двух электронных облаков на одноэлектронные, возможный лишь при наличии свободных орбиталей на внешнем энергетическом уровне. Возбуждение приводит к увеличению валентности (В) элемента, которую определяют по количеству неспаренных электронов.
Для определения возможной валентности атома необходимо:
-составить электронную формулу атома в основном состояниии;
-нарисовать схему распределения электронов по квантовым
ячейкам внешнего энергетического уровня и определить валентность атома в основном состоянии;
-последовательно распаривать электроны внешнего энергетического уровня и “отправлять” их на схеме на свободные атомные орбитали этого уровня, определяя валентность атома в возбужденном состоянии.
Пример: определение возможных валентных состояний серы
Основное состояние
16S 1s22s22p63s23p4 III 3s 3p 3d
‹ ‹‹‹ ‹‹‹‹‹ В =
Возбужденное состояние
‹ ‹‹‹ ‹‹‹‹‹ В =
Возбужденное состояние III 3s 3p 3d
‹ ‹‹‹ ‹‹‹‹‹ B =
Распределите электроны по ячейкам в основном и возбужденном сосоянии и, исходя из полученных схем, укажите возможные
валентности. Напишите электронные формулы атомов, соответствующие этим состояниям.
Дата добавления: 2015-07-25; просмотров: 103 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Www.msta.ru | | | Упражнения. |