
|
Читайте также: |
Тема: 1.3.1. «Свойства оксидов, оснований».
Цель занятия:
1. Ознакомиться с правилами техники безопасности при работе на занятиях
(на уровне знания).
2. Изучить способы получения оксидов, оснований и их химические свойства
(на уровне умения).
Время занятия: 90 мин.
Место проведения: лаборатория химии.
Оснащение: таблица «Периодическая система элементов Д. И. Менделеева»,
растворы: сульфата меди (II), гидроксида натрия, гидроксида калия, хлороводородной кислоты, цинка сульфата, серной кислоты, азотной кислоты;
индикаторы: лакмус, метилоранж, фенолфталеин;
держатели, предметные стёкла, пробирки, спиртовки.
К занятию студенты ДОЛЖНЫ ЗНАТЬ:
1. Оксиды: классификация, номенклатура, способы получения, физические и химические свойства, амфотерность оксидов.
2. Основания: классификация, номенклатура, способы получения, физические и химические свойства, амфотерные свойства.
В тетрадях по самоподготовке выполнить задания:
1. Напишите реакции взаимодействия:
а) гидроксида цинка с раствором серной кислоты.
Назовите продукты реакции.
б) оксида железа (II) с хлороводородной кислотой.
Назовите продукты реакции.
2. Допишите уравнения реакции:
NaOH + CuSO4 =
Назовите полученные соединения.
3. Уравнениями реакций подтвердите амфотерные свойства гидроксида цинка. Назовите продукты реакции.
4. Напишите уравнение реакции нейтрализации. Назовите продукты данной реакции.
5. Напишите реакцию взаимодействия оксида кальция с водой. Назовите полученное соединение.
6. Напишите уравнения реакций с помощью которых можно осуществить следующие превращения:
а) Cu 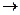 CuO
CuO 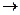 CuSO4
CuSO4 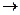 Cu (OH)2
Cu (OH)2 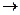 CuO
CuO
б) AlC13 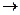 Al (OH)3
Al (OH)3 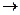 NaAlO2
NaAlO2
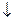
Na [ Al (OH)4 ]
На занятии студенты ДОЛЖНЫ:
I. Ответить на вопросы входного контроля.
II. Выполнить практическую работу:
1 опыт: Получение нерастворимых оснований, изучение их свойств:
CuSO4 + NaOH =
Cu (OH)2 + HCl =
t0
Cu (OH)2 =
2 опыт: Свойства амфотерных оснований:
ZnSO4 + NaOH =
недостаток
Zn (OH)2 + H2SO4 =
Zn (OH)2 + NaOH =
избыток
3. опыт: Действие щелочей на индикаторы.
Индикаторы: Реакция среднещелочная:
а) красная лакмусовая бумажка … … …
б) синяя лакмусовая бумажка … … …
в) фенолфталеин … … …
г) метилоранж … … …
Название опытов и химизм всех реакций оформить в дневнике по следующей форме:
| № п/п | Название опыта | Уравнения реакций Название продуктов реакций | Внешний эффект | Вывод |
III. Ответить на вопросы выходного контроля.
После занятия студенты ДОЛЖНЫ УМЕТЬ:
1. Правильно организовать свое рабочее место.
2. Соблюдать технику безопасности при работе на занятиях.
3. Подтвердить химические реакциями свойства основных и кислотных оксидов, оснований.
Литература:
1. Оганесян Э.Т., Книжник А.З. «Неорганическая химия»,
М. «Медицина», 1981 г. стр.42-51.
2. Конспект лекций.
Специальность: 060108 «Фармация»
Предмет: «Неорганическая химия»
Дата добавления: 2015-07-25; просмотров: 47 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ № 2 | | | К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ № 4 |