
Читайте также:
|
Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении. Для реакции пароводяной конверсии углерода константа равновесия имеет вид:
Кр = (рСО2)р (рН2)2р/(рН2О)2р,
для восстановления металла
Кр = (рН2O)р/(рН2)р.
Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях. Это особенность гетерогенного химического равновесия.
Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры для эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Расчеты проводятся по тем же формулам, что и для гомогенных реакций.
Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ. Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
__________________________________________________________________________________________________________________________________________________________________________________________
7 Вопрос
Растворы.

1.14 Явление осмоса. Осмотическое давление. Закон Вант-Гоффа применительно к растворам неэлектролитов. Роль осмотического давления в биологических системах.
Осмос – односторонняя диффузия молекул растворителя в растворе через мембрану, непроницаемую для растворенного вещества. Диффузия – самопроизвольный процесс перехода растворенного вещества в растворе из области с большей его концентрацией в область с меньшей концентрацией. Осмотическое давление – сила осуществляющая осмос. Имеет огромное значение в природе. Благодаря осмотическому давлению в растительных клетках растения через корневую систему всасывается большое количество воды. Закон Вант-Гоффа. Осмотическое давление раствора численно = тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, = объему раствора. Для идеальных растворов  С(х) – молярная концентрация, R –универсальная газовая = 101,325 кПа, Т – температура К. уравнение Вант-Гоффа позволяет изменением значений осмотического давления и температуры определять молекулярную массу вещества, если известны его масса и объем
С(х) – молярная концентрация, R –универсальная газовая = 101,325 кПа, Т – температура К. уравнение Вант-Гоффа позволяет изменением значений осмотического давления и температуры определять молекулярную массу вещества, если известны его масса и объем 
__________________________________________________________________________________________________________________________________________________________________________________________
8 Вопрос
1.17 Слабые электролиты. Степень и константа диссоциации. Взаимосвязь константы и степени диссоциации (закон разбавления Освальда)
К слабым относится большинство органических кислот и основания, образованные большинством металлов (кроме щелочных и щелочноземельных). Пример Н2S – сероводород, Н2SO3 – сернистая, NH4OH – гидрооксид аммония. По степени диссоциации делятся на слабые, сильные и средние. Слабые электролиты по степени диссоциации  .
.
Электролитическая диссоциация – процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Катионы – положительно заряженные ионы металлов. Анионы – отрицательно заряженные ионы кислотных осадков. Под действием внешнего электромагнитного поля катионы движутся к отрицательно заряженному электроду – катоду, а анионы к положительно заряженному аноду. Для характеристики соединений наряду со степенью диссоциации  важное значение имеет константа диссоциации. Степенью диссоциации называется отношение числа молекул электролита, полностью распавшихся на ионы, к общему взятому их числу.
важное значение имеет константа диссоциации. Степенью диссоциации называется отношение числа молекул электролита, полностью распавшихся на ионы, к общему взятому их числу. 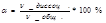
Процесс диссоциации обратим т.е. равновесию в растворе электролита всегда соответствует определенное значение константы.
закон разбавления Освальда. Константа диссоциации слабого электролита прямо пропорциональна его концентрации и квадрату степени дисскоциации.  , для очень слабых
, для очень слабых 
1.15 Основные положения теории электролитической диссоциации. Влияние природы растворителя и растворенного вещества на диссоциацию. Состояние ионов в водных растворах. Гидратация ионов. Роль гидратации ионов Рауля и Вант-Гоффа.
Электролитическая диссоциация – процесс распада молекул электролитов на ионы под действием полярных молекул растворителя. Катионы – положительно заряженные ионы металлов. Анионы – отрицательно заряженные ионы кислотных осадков. Под действием внешнего электромагнитного поля катионы движутся к отрицательно заряженному электроду – катоду, а анионы к положительно заряженному аноду. Процесс диссоциации обратим. Факторы влияющие на степень диссоциации: природа электролита. Все вещества образованные с помощью ионной связи, являются сильными электролитами. Природа растворителя. Чем полярнее молекулы растворителя, тем больше степень диссоциации. Полярные растворители – вода, жидкий аммиак. Концентрация раствора. Чем меньше концентрация раствора, тем больше степень диссоциации т.к. уменьшается вероятность обратного процесса. Изменение температуры. Нагревание и охлаждение мало влияют на степень диссоциации. Только у воды при увеличении температуры степень диссоциации заметно повышается. Влияние одноименных ионов. Присутствие одноименных ионов понижает степень диссоциации слабых электролитов.
1.19 Диссоциация воды. Ионное произведение воды. Водородный показатель рН.
Вода очень слабый электролит, диссоциирует частично на катионы водорода и гидроксид-анионы.  система находится в состоянии термодинамического равновесия. По закону действующих масс. Константа равновесия химической реакции = произведению концентраций продуктов реакции, взятых в степенях их стехиометрических коэффициентов в уровнении реакции, деленному на произведение концентраций исходных веществ, взятых в степенях их стехиометрических.
система находится в состоянии термодинамического равновесия. По закону действующих масс. Константа равновесия химической реакции = произведению концентраций продуктов реакции, взятых в степенях их стехиометрических коэффициентов в уровнении реакции, деленному на произведение концентраций исходных веществ, взятых в степенях их стехиометрических.  обозначим К*[H2O] через КН2О величина называется ионным произведением воды. Ионное произведение воды = произведению концентрации катионов водорода на концентрацию гидроксид-анионов. Константа диссоциации воды
обозначим К*[H2O] через КН2О величина называется ионным произведением воды. Ионное произведение воды = произведению концентрации катионов водорода на концентрацию гидроксид-анионов. Константа диссоциации воды  . Концентрация недиссцилированных молекул воды равна общему числу молей воды в литре 1000:18=55,56 моль/л. Тогда получим
. Концентрация недиссцилированных молекул воды равна общему числу молей воды в литре 1000:18=55,56 моль/л. Тогда получим
К*[H2O]=1,8*10-16* 55,56=10-14, следовательно  . Изменение концентраций протонов и гидроксид-ионов в растворе создает кислую или щелочную среды. [H+]<10-7 – щелочная,
. Изменение концентраций протонов и гидроксид-ионов в растворе создает кислую или щелочную среды. [H+]<10-7 – щелочная,
[H+]>10-7 – кислая.  . Водородный показатель(рН) численно = десятичному логарифму концентрации катионов водорода, взятому с обратным знаком.
. Водородный показатель(рН) численно = десятичному логарифму концентрации катионов водорода, взятому с обратным знаком.  , аналогично расчитывается гидроксидный показатель
, аналогично расчитывается гидроксидный показатель  . Для нейтральной среды [рH] =7, щелочной - [рH] >7, кислой - [рH] <7
. Для нейтральной среды [рH] =7, щелочной - [рH] >7, кислой - [рH] <7
1.20 Гидролиз солей. Константа и степень гидролиза. Факторы смещения равновесия гидролиза. Необратимый гидродиз.
Гидролиз – реакция соли с водой с образованием слабого электролита. Сопровождается изменением рН среды. Пример Na2CO3=Na++CO32- -диссоциация, CO32-+H2O=HCO3-+OH- - гидролиз. Гидролиз заключается в химическом взаимодействии ионов растворенной соли с молекулами воды, приводящим к образованию малодиссоциированных соединений и изменению реакции среды. Величина количественно характеризующая гидролиз, называется степенью гидролиза h. Степень гидролиза – отношение числа гидролизованных молекул соли к общему числу растворенных ее молекул.  . Зависимость степени гидролиза. Концентрация вещества – чем больше разбавление, тем больше степень гидролиза. Температура – чем выше температура, тем сильнее гидролиз. Добавление посторонних веществ – введение веществ дающих щелочную реакцию, подавляет гидролиз соли с рН > 7 и усиливает гидролиз с рН < 7, и наоборот вещества дающие кислую реакцию среды, увеличивает гидролиз с рН > 7 и подавляет с рН < 7. природа растворенного вещества – степень гидролиза зависит от хим. природы растворенной соли. Возможны 3 варианта. 1. Соли, образованные слабым основанием и слабой кислотой. Соли гидролизуются полностью, т.е. необратимо. Реакция среды близка к нейтральной. К ним относятся цианиды, сульфиды, сульфиты, карбонаты аммония, алюминия, хрома, железа и т.д.
. Зависимость степени гидролиза. Концентрация вещества – чем больше разбавление, тем больше степень гидролиза. Температура – чем выше температура, тем сильнее гидролиз. Добавление посторонних веществ – введение веществ дающих щелочную реакцию, подавляет гидролиз соли с рН > 7 и усиливает гидролиз с рН < 7, и наоборот вещества дающие кислую реакцию среды, увеличивает гидролиз с рН > 7 и подавляет с рН < 7. природа растворенного вещества – степень гидролиза зависит от хим. природы растворенной соли. Возможны 3 варианта. 1. Соли, образованные слабым основанием и слабой кислотой. Соли гидролизуются полностью, т.е. необратимо. Реакция среды близка к нейтральной. К ним относятся цианиды, сульфиды, сульфиты, карбонаты аммония, алюминия, хрома, железа и т.д.
Cr2S3+HOH= 2Cr(OH)3+3H2S 2Cr3++3S2-+ 6HOH= 2Cr(OH)3+3H2S
2. образованные слабым основанием и сильной кислотой. Гидролизуются не до конца. Реакция среды кислая. Катион связывает гидроксидионы, образуя слабый электролит. К ним относятся хлориды, нитраты, сульфаты аммония, алюминия, меди, цинка, хрома и др. Реакция идет ступенчато насчало с одной молекулой воды, затем со второй. 3. соли образованные сильным основанием и слабой кислотой. Гидролиз идет не до конца, реакция среды щелочная. Анион связывает протон, образуя слабый электролит. К ним относятся карбонаты, силикаты, сульфиты, сульфиды щелочных и щелочноземельных металлов. Гидролиз осуществляется по анионам слабых кислот и протекает ступенчато, с образованием кислых солей.
1.21 Буферные растворы. Определение. Механизм действия. Формула для расчета рН-среды буферных растворов. Буферная емкость.
Буферные растворы – растворы которые практически не изменяют свое значение рН при разбавлении или добавлении к ним определенных количеств сильной кислоты или сильного основания. Вывод формул. 1. Кислотный буфер. В растворе содержится слабая кислота и ее соль. Кислота диссоциирует
НА =H++A-. Константа диссоциации  соль диссоциирует полностью. Найдем концентрацию водородных ионов
соль диссоциирует полностью. Найдем концентрацию водородных ионов  . Прологарифмируем
. Прологарифмируем 
-lg[H+]= pH, обозначим –lgKa=pKa,
перепишем уравнение  Са – концентрация кислоты,
Са – концентрация кислоты,
Сs – концентрация соли. Если концентрации и объемы не равны то
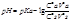 2. основной буфер. Состоит из слабого основания и его соли.
2. основной буфер. Состоит из слабого основания и его соли.  Кв – константа диссоциации рКв=-lgKв, Св – концентрация основания, Сs – концентрация соли. Если концентрации и объемы не равны то
Кв – константа диссоциации рКв=-lgKв, Св – концентрация основания, Сs – концентрация соли. Если концентрации и объемы не равны то  .
.
Буферная емкость. Выражается количеством вещества эквивалента сильной кислоты или основания, которое необходимо добавить к 1 литру буферного раствора, чтобы сместить значение его рН на единицу.  ,
,  кол-во эквивалента прибавляемых кислоты или основания.
кол-во эквивалента прибавляемых кислоты или основания.
 разность значений буф. раствора до и после прибавления кислоты или основания. Если прибавляем кислоту то рН1 - рН2, если основание то рН2 - рН1.
разность значений буф. раствора до и после прибавления кислоты или основания. Если прибавляем кислоту то рН1 - рН2, если основание то рН2 - рН1.
__________________________________________________________________________________________________________________________________________________________________________________________
9 Вопрос
Дата добавления: 2015-07-25; просмотров: 154 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Свойства атома | | | Окислительно-восстановительные реакции |