
Читайте также:
|
Неорганическая химия.
1 ВОПРОС
Основные понятия и законы химии. Эквивалент
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. Химические явления: одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется. Физические явления: меняется физическое состояние веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или образуются новые вещества с изменением состава ядер атомов.
1. Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему
Атомное ядро - центральная часть атома, состоящая из протонов(Z) и нейтронов(N), в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула - это условная запись состава вещества с помощью химических знаков и индексов. Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества - молекулы, состоят из атомов одного и того же элемента.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C. Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Молярная масса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность - моль-1).
Молярный объём — объём одного моль вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул. Значение NA = 6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества. Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моль железа (Fe), молекул в 1 моль воды H2O и т. д.Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём Vm = 22,4 л/моль. При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратное.Из закона Авогадро вытекает еще одно важное следствие: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта постоянная величина называется относительной плотностью газа и обозначается D. Так как молярные объемы всех газов одинаковы (следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной: D = М1/М2 где М1 и М2 – молярные массы двух газообразных веществ. Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа М1 и эталонного газа с известной молекулярной массой М2. По величинам D и М2 можно найти молярную массу исследуемого газа.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1. Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы: fЭ (формульная единица вещества) º эквивалент Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть. Таблица 1.1 – Расчет фактора эквивалентности:
Элемент  где В(Э) – валентность элемента
где В(Э) – валентность элемента
Простое вещество 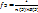 , где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
, где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
Оксид 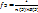 , где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
, где n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
Кислота 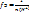 , где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
, где n(H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
Основание  ,где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
,где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
Соль 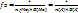 , где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка
, где n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка
Частица в окислительно-восстановительных реакциях  , где n(e) – число электронов, участвующих в процессе окисления или восстановления
, где n(e) – число электронов, участвующих в процессе окисления или восстановления
Ион  , где z – заряд иона
, где z – заряд иона
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества nэ. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности: МЭ = М×fЭ. Молярная масса эквивалента имеет размерность «г/моль». Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
МЭ(оксида) = МЭ(элемента) + МЭ(О) = МЭ(элемента) + 8
МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) = 1 + МЭ(кислотного остатка)
МЭ(основания) = МЭ(Ме) + МЭ(ОН) = МЭ(Ме) + 17
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Основные стехиометрические законы
Закон сохранения массы веществ
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами. Это один из основных законов химии.
Дата добавления: 2015-07-25; просмотров: 187 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Устройство | | | Закон Авогадро |