
Читайте также:
|
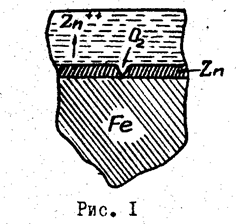 Наиболее распространенный метод - применение защитных покрытий, которые делятся на металлические, неорганические и органические. Все защитные покрытия, прежде всего, изолируют поверхность металла от агрессивной коррозионной среды; такая защита называется механической. Кроме того, металлические покрытия по характеру защиты могут быть анодными или катодными. Анодными называются такие покрытия, металл которых имеет более отрицательный электродный потенциал, чем основной металл (например, слой цинка на железе). В случае повреждения анодного покрытия в растворе электролита или в тонкой пленке влаги возникает коррозионный элемент, в котором анодом является металл покрытия, т.е. цинк. Цинк подвергается растворению, а на основном металле протекает катодный процесс. Таким образом, анодное покрытие защищает металл от коррозии не только механически, но и электрохимически (рис. 1).
Наиболее распространенный метод - применение защитных покрытий, которые делятся на металлические, неорганические и органические. Все защитные покрытия, прежде всего, изолируют поверхность металла от агрессивной коррозионной среды; такая защита называется механической. Кроме того, металлические покрытия по характеру защиты могут быть анодными или катодными. Анодными называются такие покрытия, металл которых имеет более отрицательный электродный потенциал, чем основной металл (например, слой цинка на железе). В случае повреждения анодного покрытия в растворе электролита или в тонкой пленке влаги возникает коррозионный элемент, в котором анодом является металл покрытия, т.е. цинк. Цинк подвергается растворению, а на основном металле протекает катодный процесс. Таким образом, анодное покрытие защищает металл от коррозии не только механически, но и электрохимически (рис. 1).
Катодными называются такие покрытия, у которых электродный потенциал металла покрытия имеет более положительное значение, чей электродный потенциал основного металла (например, слой олова на железе). При работе коррозионного элемента, составленного из таких металлов, разрушению будет подвергаться основной металл. Следовательно, катодное покрытие защищает металл от коррозии только механически (рис. 2)
 При защите неорганическими покрытиями на поверхности металла получается слой стойкого химического соединения.
При защите неорганическими покрытиями на поверхности металла получается слой стойкого химического соединения.
При оксидировании стальных деталей на их поверхности образуется оксидная пленка черного цвета, состоящая преимущественно из магнетита Fe3O4.
Среди различных способов оксидирования сталей наибольшее распространение имеет щелочной метод, предложенный доцентом В. И. Забываевым.
Защитные свойства оксидного слоя могут быть повышены путем промасливания только что нанесённого слоя.
Фосфатирование изделий из железа, цинка и сплавов на основе этих металлов осуществляют нагреванием в 3%-ном растворе препарата "Мажеф", который представляет собой смесь дигидрофосфатов марганца и железа. Эти соли в растворе диссоциируют с образованием фосфат- и гидрофосфат-ионов.
Процесс фосфатировання имеет электрохимический характер. На катодных участках металлической поверхности выделяется водород:
На анодных участках ионы металла переходят в раствор:
Ионы металлов образуют с фосфат- и гидрофосфат-ионами труднорастворимые двухзамещенные и нормальные фосфаты, которые кристаллизуются на металлической поверхности в виде темно-серого осадка.
Фосфатные покрытия слабо предохраняют металлы от коррозии и большей частью применяются в качестве грунта под окраску. Защитные свойства их могут быть повышены пропиткой минеральными маслами или раствором K2Cr2O7.
Электрохимическая коррозия может быть в большой мере замедлена в присутствии небольших количеств веществ, называемых в соответствии с характером их действия замедлителями, или ингибиторами.
Ингибиторы коррозии бывают неорганического и органического происхождения. Они широко применяются для защиты металлов. Из неорганических замедлителей часто используются хроматы, нитриты, силикаты и другие вещества. Механизм их действия различен и сводится к образованию защитных пленок. Ионы CrO42+ или Cr2O72- адсорбируются на активных участках металлической поверхности, делая невозможной коррозию.
Аналогичную роль могут играть полярные молекулы ряда органических веществ, в состав которых входят кислород, сера или азот (амины, пиридин, уротропин и др.).
Среди методов защиты металлов от коррозии особое место занимает электрохимическая защита. Этот метод защиты применим только в токопроводящей среде. Сущность метода заключается в том, что вся поверхность подлежащего защите металлического сооружения искусственно делается катодом. На практике это осуществляется в основном двумя способами.
1) Катодная защита. При этом защищаемое сооружение присоединяют к катоду внешнего источника постоянного тока. В качестве анода используют дополнительный электрод (металлический стержень или пластинку), который подвергается разрушению, предохраняя тем самим от коррозии защищаемое сооружение.
2) Протекторная защита. Защищаемый металлический объект приводят в контакт с другим металлом, имеющим болей отрицательный электродный потенциал, чей защищаемый металл. Деталь из более активного металла называется протектором. В образовавшейся гальванической паре протектор является анодом, 8 защищаемый металлический объект - катодом. В этих условиях протектор постепенно разрушается, а коррозия металлической конструкции почти прекращается.
При помощи электрохимической защиты предохраняют от коррозии морские суда, буи, сваи и эстакады, сооруженные в воде, подземные и подводные трубопроводы, силовые кабели, кабели связи, внутренние поверхности резервуаров, химическую и теплообменную аппаратуру и пр.
Дата добавления: 2015-07-11; просмотров: 151 | Нарушение авторских прав