
|
Читайте также: |
При погружении металла в раствор электролита между поверхностью металла и электролитом возникает определенная разность потенциалов, что связано с образованием двойного электрического слоя, т.е. несимметричного распределения заряженных частиц на границе раздела фаз. Рассмотрим ситуацию на границе раздела фаз металла – электролит (рис.1). В этом случае, если энергия гидратации ионов достаточна для разрыва связи между ион-атомами металла и электронами и ион-атомы переходят в раствор, на поверхности металла остается эквивалентное число электронов, которые сообщают поверхности металла отрицательный заряд. В дальнейшем эти отрицательные заряды протягивают катионы металла из раствора. В результате на границе раздела металл – электролит возникает двойной электрический слой, что и вызывает появление некоторой разницы потенциалов между металлом и раствором электролита (рис.1,а). Возможен и другой вариант: на поверхности металла могут разряжаться катионы из раствора электролита (энергия связи в кристаллической решетке больше энергии гидратации)
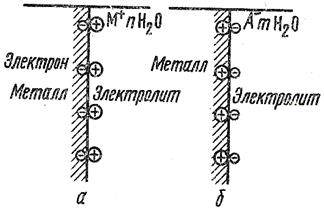 (рис 1,б). В результате поверхность металла приобретает положительный заряд и образует двойной электрический слой с анионами раствора.
(рис 1,б). В результате поверхность металла приобретает положительный заряд и образует двойной электрический слой с анионами раствора.
Рис.6 Схема образования двойного электрического слоя
а – при переходе иона атома металла в раствор
б – при переходе катиона из раствора на поверхность металла
Величины электродных потенциалов оказывают большое влияние на характер коррозионного процесса, поэтому необходимо знать значения этих потенциалов и действительную разность потенциалов между металлом и раствором электролита.
В настоящее время нет экспериментальных способов измерения и теоретических методов расчета абсолютных электродных потенциалов, поэтому измеряют относительные значения потенциалов, используя для этого так называемые электроды сравнения. За основной электрод сравнения принят стандартный электрод (рис. 2) из платинированной (черненной) пластины (1), погруженный в раствор кислоты (2) с активностью ионов Н+, равной 1 г-ион/л.
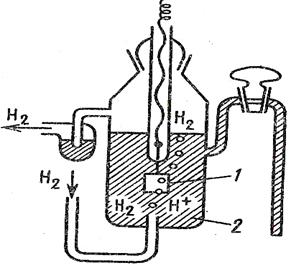
Рис.7 Водородный электрод сравнения
Равновесный электродный потенциал зависит от природы металла и растворителя, температуры электролита, активности ионов металла. Значение такого потенциала (φ) можно рассчитать по уравнению Нернста:
 =
= 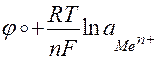 ,
,
где φ° - стандартный потенциал металла, В;
R – молярная газовая постоянная;
Т – абсолютная температура, К;
n – степень окисления иона металла;
F – постоянная Фарадея;
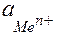 – активность ионов металла, г-ион/л.
– активность ионов металла, г-ион/л.
Электродные потенциалы металла, у которых в процессе обмена участвуют не только собственные, но и другие ионы и атомы, называют неравновесными или необратными. При коррозии металлов устанавливаются неравновесные электродные потенциалы и в этом случае уравнение Нернста неприменимо, поэтому значения неравновесных электродных потенциалов определяют экспериментально.
Дата добавления: 2015-07-11; просмотров: 244 | Нарушение авторских прав