
Читайте также:
|
· Составляют схему гальванопары:
Ме1 / среда / Ме2.
· Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (из справочника), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
· Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при гальванокоррозии.
· Указывают направление движения электронов.
Пример 1. Гальванопара алюминий – железо в воде (среда нейтральная)
В воде растворен кислород.
Решение.
· Схема гальванопары: Al / H2O, O2 / Fe
· Потенциалы 
 0 Al(ОН)
0 Al(ОН)  / Al = –1, 88 В;
/ Al = –1, 88 В; 
 0 Fe (ОН)
0 Fe (ОН) 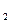 / Fe = –0, 46 В;
/ Fe = –0, 46 В;
 0 О
0 О 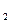 / 4 ОН
/ 4 ОН 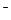 = + 0, 81 В.
= + 0, 81 В.
· Восстановитель – Al (анод), Fe – катод, окислитель – О2 .
·  Al (–): Al – 3е‾ + 3 H2O = Al(ОН)
Al (–): Al – 3е‾ + 3 H2O = Al(ОН)  + 3Н+ 4 – процесс окисления;
+ 3Н+ 4 – процесс окисления;
Fe (+): О2 + 4е‾ + 2Н2О = 4ОН ‾ 3 – процесс восстановления
 4Al + 3О2 + 6H2O = 4Al(ОН)
4Al + 3О2 + 6H2O = 4Al(ОН) 
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
е ‾



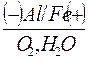 е ‾
е ‾
Пример 2. Определить процессы, протекающие при коррозии луженого железа (среда – влажный воздух, содержащий кислород, пары воды и ионы Н+), если нарушена сплошность покрытия.
Решение.
· Схема гальванопары: Fe / H2O, O2, Н+ / Sn
· Потенциалы 
 0 Fe
0 Fe  / Fe = – 0, 44 В;
/ Fe = – 0, 44 В; 
 0 Sn
0 Sn  / Sn = – 0, 136 В;
/ Sn = – 0, 136 В;
 0 О
0 О 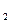 / 2 Н
/ 2 Н 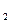 О = + 1, 228 В.
О = + 1, 228 В.
Восстановитель – Fe (анод), Sn – катод, окислитель – О2 .
·  Fe(–): Fe – 2е ‾ = Fe2+ 2 – процесс окисления
Fe(–): Fe – 2е ‾ = Fe2+ 2 – процесс окисления
Sn (+): О2 + 4е ‾ + 4Н+ = 2Н2О 1 – процесс восстановления
 |
2 Fe + О2 + 4Н+ = 2Fe2+ + 2Н2О
2Fe + О2 + 4НСl = FeСl 2 + 2Н2О
При нарушении целостности покрытия будет разрушаться железо.
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
 е ‾
е ‾

 е ‾
е ‾
Пример 3. Рассмотреть коррозию детали из железа и алюминия в щелочной среде (КОН), если растворенный кислород отсутствует.
Решение.
· Схема гальванопары: Al / КОН / Fe
· Потенциалы 
 0 Al О ‾/ Al = – 2, 36 В;
0 Al О ‾/ Al = – 2, 36 В; 
 0 Fe(ОН)
0 Fe(ОН) 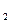 / Fe = – 0,874 В;
/ Fe = – 0,874 В;
 02Н
02Н 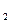 О/Н
О/Н 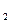 = – 0,827 В.
= – 0,827 В.
· Восстановитель – Al (анод), Fe (катод), окислитель – Н2О.

Al (–): Al – 3е‾ + 4 ОН ‾ = AlО2 – + 2 Н2О 2 – процесс окисления
Fe(+): 2Н2О + 2е- = Н2 + 2ОН ‾  3 – процесс восстановления
3 – процесс восстановления
 |
2 Al + 8 ОН ‾ + 2Н2О = 2AlО2 – + 3 Н2
2 Al + 8 КОН + 2Н2О = 2 КAlО2 – + 3 Н2 Разрушается алюминий.
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
е ‾


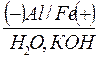 е ‾
е ‾
Пример 4. Как проходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах?
Решение.
· Схема гальванопары: Zn / H2O, O2 / Cd и Zn / H2O, Н+ / Cd
· Потенциалы 
 0 Zn
0 Zn  / Zn = – 0,763 В
/ Zn = – 0,763 В 
 0 Cd
0 Cd  / Cd = – 0, 403 В
/ Cd = – 0, 403 В
 0 О
0 О 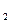 / 4 ОН
/ 4 ОН  = + 0, 81 В.
= + 0, 81 В.
· Восстановитель – Zn (анод), Cd – катод, окислитель – Н2О.
а) нейтральная среда
 Zn(–): Zn – 2е ‾ = Zn2+ 2 – процесс окисления
Zn(–): Zn – 2е ‾ = Zn2+ 2 – процесс окисления
Cd (+): 2Н2О + О2 + 4е- = 4ОН‾ 1 – процесс восстановления
 |
2Zn + 2Н2О + О2 = 2Zn2+ + 4ОН‾
2Zn + 2Н2О + О2 = 2Zn(ОН)2
 б) кислая среда
б) кислая среда
Zn(–): Zn – 2е ‾ = Zn2+ 1 – процесс окисления
Cd (+): 2Н+ + 2е ‾ = Н2  1 – процесс восстановления
1 – процесс восстановления

Zn + 2Н+ = Zn2+ + Н2 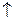
Zn + Н2SО4 = ZnSО4 + Н2 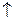
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
а) в нейтральном растворе е ‾


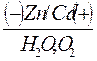 е ‾
е ‾
· Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом:
е ‾
 б) в кислом растворе
б) в кислом растворе 
 (например, серной кислоты)
(например, серной кислоты) 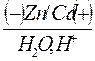 е ‾
е ‾
Пример 5. Как проходит коррозия железа, содержащего в качестве примеси медь?
Решение.
· Схема гальванопары: Fe / H2O, O2 / Cu
· Потенциалы 
 0 Fe
0 Fe  / Fe = – 0, 44 В;
/ Fe = – 0, 44 В; 
 0 Cu
0 Cu  / Cu = – 0, 34 В;
/ Cu = – 0, 34 В;
 0 О
0 О 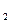 / 2 Н
/ 2 Н 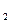 О = + 1, 228 В.
О = + 1, 228 В.
Восстановитель – Fe (анод), Cu – катод, окислитель – О2 .
а) нейтральная среда (влажный воздух)
 Fe(–): Fe – 2е ‾ = Fe2+ 2 – процесс окисления
Fe(–): Fe – 2е ‾ = Fe2+ 2 – процесс окисления
Cu(+): 2Н2О + О2 + 4е- = 4ОН‾ 1 – процесс восстановления
 |
2 Fe + О2 + 2Н2О = Fe2+ + 4ОН‾
2Fe + О2 + 2Н2О = Fe(ОН) 2
Далее Fe(ОН) 2 подвергается воздействию влаги и кислорода воздуха:
4 Fe(ОН) 2 + 2Н2О + О2 = 4 Fe(ОН)3
· Образовавшийся гидроксид железа (III) переходит затем в Fe2О3∙3Н2О или
FeООН – ржавчину.
б) кислая среда (растворенный кислород отсутствует)
· Потенциалы 
 0 Fe
0 Fe  / Fe = – 0, 44 В;
/ Fe = – 0, 44 В; 
 0 Cu
0 Cu  / Cu= + 0, 34 В;
/ Cu= + 0, 34 В;
 02Н
02Н 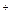 /Н
/Н 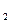 = – 0,0 В.
= – 0,0 В.
 |
Fe (–): Fe – 2е ‾ = Fe2+
Cu (+): 2Н+ + 2е ‾ = Н2 

Fe + 2Н+ = Fe2+ + Н2 
Fe + 2НСl = FeСl2 + Н2
е ‾ е ‾


 е ‾
е ‾ 
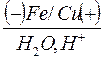 е ‾
е ‾
Тест. 2 «Коррозия металлов»
1. Наиболее активно корродирует
1) техническое железо
2) химически чистое железо
3) железо, слоем олова
4) сплав железа с хромом и никелем
2. В случае электрохимической коррозии находящихся в контакте металлов
1) на аноде идет восстановление
2) на катоде идет окисление
3) менее активный металл является анодом
4) менее активный металл является катодом
3. В случае электрохимической коррозии находящихся в контакте металлов железа и меди в кислой среде
1) на катоде идет растворение железа
2) на катоде идет восстановление катионов водорода до молекулярного водорода
3) на катоде идет восстановление кислорода до гидроксид-ионов
4) на катоде идет растворение меди
4. При лужении железа оно покрывается тонким слоем
1) меди 2) цинка 3) олова 4) никеля
5. Ингибитором при хранении соляной кислоты
служат производные
1) анилина 2) бутиламина
3) аланина 4) ванилина
Тест. 3 «Коррозия металлов»
1. Электрохимическую коррозию вызывает
1) контакт металла с кислородом
2) контакт металла с оксидами серы
3) контакт металла с другими металлами
4) контакт металла с водой
2. В случае электрохимической коррозии находящихся в контакте металлов
1) на аноде идет восстановление
2) на катоде идет восстановление
3) более активный металл является катодом
4) менее активный металл является анодом
3. В случае электрохимической коррозии находящихся в контакте металлов железа и меди в щелочной или
нейтральной среде
1) на катоде идет восстановление катионов водорода до молекулярного водорода
2) на катоде идет растворение железа
3) на катоде идет растворение меди
4) на катоде идет восстановление кислорода до гидроксид-ионов
4. Для протекторной защиты стальных изделий используют протекторы из
1) Mg и Zn 2) Al и Cu 3) Ca и Sn 4) Co и Cr
5. К электрохимическим методам защиты металлов от коррозии относятся
1) никелирование 2) шлифование
3) воронение 4) катодная защита
Тест.4 «Коррозия металлов»
1. Химическую коррозию металла вызывают
1) кислород 2) все перечисленные вещества
3) хлор 4) оксиды серы
2. В случае электрохимической коррозии находящихся в контакте металлов
1) на аноде идет окисление
2) на катоде идет окисление
3) более активный металл является катодом
4) менее активный металл является анодом
3. В случае электрохимической коррозии находящихся в контакте металлов железа и меди в щелочной или
нейтральной среде
1) на аноде идет восстановление кислорода до гидроксид-ионов
2) на аноде идет растворение меди
3) на аноде идет растворение железа
4) на аноде идет восстановление катионов водорода до молекулярного водорода
4. В качестве легирующих добавок при получении нержавеющих сталей используют
1) Mn и Zn 2) Ag и Au 3) Ni и Cu 4) Ni и Cr
5. Ингибитором при перевозке серной кислоты
в железнодорожных цистернах служит
1) азотная кислота 2) уксусная кислота
3) сернистая кислота 4) соляная кислота
Тест 1. «Коррозия металлов»
1. Наиболее активно корродирует
1) химически чистое железо
2) железо в отсутствии влаги
3) техническое железо во влажном воздухе
4) техническое железо в растворе электролита
2. Что замедляет коррозию металлических деталей. находящихся в воде?
1) наличие ионов водорода
2) наличие ионов хлора
3) применение для соединения деталей заклепок из более активных металлов
4) применение для соединения деталей заклепок из менее активных металлов
3. В случае электрохимической коррозии находящихся в контакте металлов
1) на аноде идет растворение железа
2) на аноде идет растворение меди
3) на аноде идет восстановление кислорода до гидроксид- ионов
4) на аноде идет восстановление катионов водорода до молекулярного водорода
4. Для получения защитных металлических покрытий железа используются металлы, которые по сравнению с железом
1) более активные
2) и более активные, и менее активные
3) менее активные
4) металлы не используются
5. При подготовке воды, поступающей в котельные установки, её подвергают деаэрации для удаления из нее
1) азота 2) водорода
3) кислорода 4) аргона
Тест. 5 «Коррозия металлов»
1. Контакт с какими металлами ослабит коррозию
цинка в солянокислой среде?
1) железо 2) алюминий
3) золото 4) магний
2. В случае электрохимической коррозии находящихся в контакте металлов цинка и меди в щелочной или
нейтральной среде
1) на катоде идет восстановление катионов водорода до молекулярного водорода
2) на катоде идет растворение цинка
3) на катоде идет растворение меди
4) на катоде идет восстановление кислорода до гидроксид-ионов
3. В случае электрохимической коррозии находящихся в контакте металлов
1) на аноде идет восстановление
2) на катоде идет окисление
3) менее активный металл является анодом
4) менее активный металл является катодом
4. Электрохимическую коррозию вызывает
1) контакт металла с кислородом
2) контакт металла с оксидами серы
3) контакт металла с другими металлами
4) контакт металла с водой
5. Что усиливает коррозию металлических деталей, находящихся в воде?
1) добавление в воду ингибитора
2) применение для соединения деталей заклепок из более активного металла
3) применение для соединения деталей заклепок из менее активного металла
4) окрашивание деталей
Тест. 6 «Коррозия металлов»
1. Коррозия металлов в воде может быть обусловлена:
1) растворенным кислородом
2) азотом
3) наличием примесей других металлов
4) ионами водорода
2. Контакт с какими металлами усилит коррозию железа
в солянокислой среде?
1)цинком 2)золотом
3) медью 4) магнием
3. В случае электрохимической коррозии находящихся в контакте металлов
1) на катоде идет окисление
2) на аноде идет восстановление
3) более активный металл является анодом
4) более активный металл является катодом
4. Химическую коррозию металла вызывают
1) оксиды азота 2) кислород
3) фтор 4) все перечисленные вещества
5. В случае электрохимической коррозии находящихся в контакте металлов железа и цинка в щелочной или
нейтральной среде
1) на катоде идет восстановление катионов водорода до молекулярного водорода
2) на катоде идет растворение железа
3) на катоде идет растворение цинка
4) на катоде идет восстановление кислорода до гидроксид-ионов
Дата добавления: 2015-07-11; просмотров: 592 | Нарушение авторских прав