
|
Читайте также: |
Скорость химической коррозии металлов определяется или скоростью самого кристаллохимического процесса образования пленки, или скоростью встречной двусторонней диффузии через пленку действующего реагента и металла.
Линейный закон окисления металла
Если при окислении металлов протекают процессы, не приводящие к образованию сплошной оксидной пленки, что возможно при наличии возгоняющихся в данных условиях оксидов, рыхлых пористых или растрескивающихся оксидов, скорость коррозии может контролироваться либо скоростью химической реакции кислорода и металла, либо скоростью процессов, вызывающих нарушение целостности оксидной пленки. В предельном случае, когда продукты взаимодействия не защищают металл от окислительной среды, скорость окисления будет определяться также скоростью химической реакции. Таким образом, максимально возможная скорость химической коррозии металла - это скорость химической реакции взаимодействия металла и кислорода.
Так как в рассмотренных случаях пленка практически не препятствует окислению металла ни на одном этапе, то скорость окисления должна оставаться постоянной в течение всего процесса окисления.
dh / dτ = K1 (3.1)
где K1 - константа скорости роста оксидной пленки, зависящая от концентрации кислорода в газовой фазе и давления газа (с увеличением этих параметров она также увеличивается); h - толщина пленки; τ - время.
Интегрирование уравнения (3.1) дает возможность найти закон роста пленки во времени:
h = K1τ+С1 (3.2)
этот закон называется линейным. С1 - постоянная интегрирования, равная толщине пленки в начальный момент: С1 = h0 при τ = 0. Если h0 =0 (при τ = 0), то С = 0 и уравнение (3.2) принимает вид:
h = K1 ∙ τ (3.3)
Для нахождения константы K1 в случае линейного закона строится график (см. рисунок 1) в координатах h = f(τ), представляющий собой прямую линию, тангенс угла наклона которой равен K1 (tgα = K1).
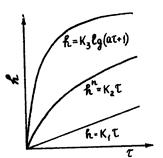
Риcунок – 1 Законы роcта пленок на металлах: линейный,
параболический и логарифмический законы в координатах
h - τ
Параболический закон окисления металла
Параболическое окисление наблюдается в тех случаях, когда на поверхности металла образуется сплошная, плотно прилегающая к его поверхности оксидная пленка. Закономерности роста такой пленки определяются закономерностью перемещения в ней частиц окислителя и металла. Такими частицами в общем случае могут быть катионы, анионы и электроны. Механизм перемещения частиц в пленке представляет собой диффузию. Независимо от места расположения зоны роста пленки (со стороны газовой среды, металла или внутри пленки), кинетическая закономерность окисления одинакова - она выражается уравнением квадратичной параболы. Уравнение роста оксидной пленки в этом случае имеет вид:
h2 = K2 τ (3.4)
Параболический закон окисления имеет место при взаимодействии с кислородом многих металлов. Однако наиболее часто на практике встречается закономерность окисления, описываемая степенным законом роста (см. рисунок 1)
 (3.5)
(3.5)
где К3 - константа скорости окисления; n - показатель степени, причем 1< n ≤2 или n >2; иногда окисление описывается кубическим уравнением.
Если кривая имеет вид зависимости (3.5), то для подтверждения справедливости установленной зависимости, нахождения показателя n и константы K3 кривую спрямляют, строят график (см. рисунок 2) в координатах lg h = f(lg τ), который для параболической зависимости должен дать прямую
lgh = 1/n lg K3+1/n lg τ,
где 1/n = tg α, lgK3/n - отрезок, отсекаемый на оси ординат (при lg τ = 0).

Рисунок 2 – График для определения параметров " n " и " К3 " в случае параболического закона роста пленок
Значение показателя n и константы К3 находят из графика: 1) n = ctg α, 2) 1/n lg K3 = lgh при lg τ = 0 или
lg K3 = n lgh, откуда при известном значении n рассчитывается значение постоянной K3.
Возможны случаи, когда первоначально процесс окисления металлического материала может протекать с образованием защитной оксидной пленки с показателем n ≥ 2 в кинетическом уравнении (3.5), а с увеличением длительности изотермической выдержки происходит разрушение (растрескивание, осыпание) оксидной пленки, и n становится ≤ 1.
Изменение в структуре пленки по мере ее роста может привести к изменению величины n и К3 в уравнении (3.5). Смена законов в процессе окисления металлов характерна для так называемого паралинейного закона (в начальный период - параболический, затем - линейный закон). Переход к линейному закону соответствует установлению равенства скоростей образования окисла (во внутренней части) и разрушения его (снаружи).
Для описания зависимости толщины пленки от времени (1<n<2), в общем виде может быть использовано уравнение, предложенное Эвансом
K1h2+K2h = K1K2 τ (3.6)
Для нахождения неизвестных K1 и K2 уравнение преобразуют к виду: τ/h =1/K1+h/K2 и строят график в координатах τ/h = f(h), который должен дать прямую линию (см. рисунок 3). Тангенс угла наклона этой линии tgα = 1/K2, а 1/K1 - отрезок, отсекаемый на оси ординат (при h = 0).
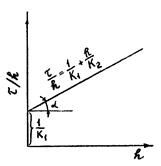
Рисунок 3 – Параболический закон в координатах (τ/h)–h
Логарифмический закон окисления металлов
Этот закон наблюдается при относительно низких температурах или на начальных стадиях окисления и обычно характерен для тонких оксидных пленок (~ 10 нм). Его особенностью является более интенсивное торможение роста пленки с течением времени, чем при параболическом законе.
Логарифмический закон окисления металла имеет вид:
 или
или  , (3.7)
, (3.7)
где К, a, b, К3 и К4 – постоянные.
Или обратный логарифмический закон
 , (3.8)
, (3.8)
где С, К1 – постоянные.
Для нахождения констант строят график  (см. рисунок 4), где К3 = tg α, а К4 – отрезок, отсекаемый на оси ординат при lg τ = 0.
(см. рисунок 4), где К3 = tg α, а К4 – отрезок, отсекаемый на оси ординат при lg τ = 0.

Рисунок 4 – Логарифмический закон роста окисной пленки
Существует ряд теорий, объясняющих эти законы роста плёнки. В основе этих теорий – контролирующей стадией окисления металлов является перенос ионов или электронов в тонких плёнках по механизмам, отличающихся от диффузионного механизма.
Температура очень сильно влияет на процесс окисления материалов. В подавляющем большинстве случаев с повышением температуры процесс окисления материалов протекает значительно быстрее, несмотря на уменьшение его термодинамической возможности (уменьшение движущей силы процесса). Это связано с тем, что скорость любого процесса равна отношению движущей силы на сопротивление. Если сопротивление уменьшается несоизмеримо больше, чем движущая сила процесса, то зависимость скорости процесса окисления материалов от температуры при контролирующих стадиях диффузии, миграции реагирующих частиц, химической реакции подчиняется уравнению Аррениуса (см. рисунок 5)
К = А · exp(-Q / RT) (3.9)
где К – константа скорости химической реакции; А – предэкспоненциальный множитель, равный К при 1/Т = 0; Q – энергия активации химической реакции; R – универсальная газовая постоянная; Т – температура.


Рисунок – 5 Температурная зависимость константы скорости окисления металла в координатах: а) К – Т; б) lg K – 1/Т
Расчет энергии активации и константы А по опытным данным дает возможность вычислить скорость процесса при любой температуре в выбранном интервале, где сохраняется установленный закон роста окисной пленки.
Для определения А и Q прологарифмировав уравнение (3.9) получим
ln K = ln А – Q/(RT) или
lg K = lg А – Q/(2,303RT) (3.10)
Строят график в координатах lgK – 1/Т (рис. 5, б), который выражается прямой, для которой  ;
;  при 1/Т = 0.
при 1/Т = 0.
При подстановке в кинетическое уравнение  уравнения (3.9) получаем
уравнения (3.9) получаем
 (3.11)
(3.11)
После логарифмирования уравнения (3.11) и принятия τ =1, оно преобразуется в следующее
 (7.30)
(7.30)
Из уравнений (3.10) и(3.11) следует, что только в тех температурных интервалах, где не происходит изменение показателя степени (n = const), можно, используя метод наименьших квадратов, рассчитать А и Q. Для их расчета обязательно нужно знать по какому кинетическому закону в данном температурном интервале протекает процесс окисления материала.
Дата добавления: 2015-07-11; просмотров: 256 | Нарушение авторских прав