
|
Читайте также: |
Движущей силой реакции "металл-окислитель" является изменение свободной энергии системы, обусловленное образованием продуктов реакции из реагентов. В качестве критерия при оценке возможности или невозможности коррозионного процесса обычно используется энергия Гиббса GТ. Любой самопроизвольный процесс, протекающий при постоянном давлении и температуре сопровождается убылью величины GТ. Если при заданных условиях Δ GТ < 0, коррозионный процесс термодинамически возможен. При Δ GТ > 0 процесс окисления невозможен и при наличии уже существующих продуктов коррозии (например, оксид или сульфид металла) происходит их диссоциация. При Δ GТ = 0 имеет место равновесие: если оксид образовался, то в данных условиях его рост не происходит. Для решения вопроса о возможности или невозможности протекания коррозионного процесса в заданных условиях необходимо воспользоваться справочными данными или произвести соответствующей расчет.
Наиболее важным и общим методом расчета изменения энергии Гиббса является ее определение из данных химического равновесия, которое можно рассмотреть на примере окисления металла (Ме) кислородом:
mMe(т)+mn/4 О2(г) = MemОmn/4 (1.1)
Согласно уравнению изотермы Вант-Гоффа для химической реакции (2.1), изменение энергии Гиббса может быть представлено в виде
 (1.2)
(1.2)
где R = 8,314 Дж /(моль∙К) - универсальная газовая постоянная; Т - абсолютная температура, К; Ро2 - парциальное давление кислорода, атм; (Ро2)р - парциальное давление кислорода в равновесном состоянии, равное давлению (упругости) диссоциации оксида, атм; Kp – константа химического равновесия; m – число атомов металла в молекуле окисла; n – валентность металла;  – изменение стандартной энергии Гиббса (РО2 = 1атм), Дж/моль.
– изменение стандартной энергии Гиббса (РО2 = 1атм), Дж/моль.
Из уравнения (1.2) следует, что окисление металла термодинамически возможно (Δ GТ < 0) при условиях Ро2 > (Ро2)р и невозможно (Δ GТ > 0), если Ро2 < (Ро2) р.
Значение 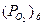 служит мерой термодинамической устойчивости оксида: чем ниже
служит мерой термодинамической устойчивости оксида: чем ниже  , тем более устойчиво это химическое соединение.
, тем более устойчиво это химическое соединение.
Упругость диссоциации оксида можно рассчитать по формуле
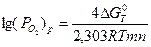 , (1.3)
, (1.3)
где Δ GТ0 - стандартное изменение энергии Гиббса (при Ро2 = 1 атм =  Па).
Па).
Дата добавления: 2015-07-11; просмотров: 160 | Нарушение авторских прав