
Читайте также:
|
Пример 1. Экспериментальная зависимость изменения массы образца кальция от времени изотермической выдержки на воздухе при 773 К представлена в таблице.
| Время | ||||||||
Увеличение массы  , г/м , г/м 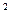
|
Установить закон окисления кальция, сделать вывод о механизме окисления и рассчитать удельный прирост массы образца после выдержки при заданной температуре в течение 50 ч.
Решение.
По опытным данным строим график в координатах 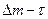 (см. рисунок 6). График представляет собой прямую линию, уравнение которой имеет вид
(см. рисунок 6). График представляет собой прямую линию, уравнение которой имеет вид 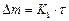 , где
, где 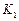 - константа скорости окисления;
- константа скорости окисления;  - увеличение массы;
- увеличение массы;  - время.
- время.
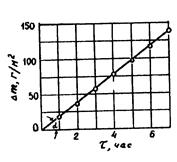
Рисунок 6 – График для определения константы скорости
окисления кальция
Из графика определяем 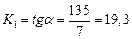 г/м
г/м 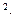 ч, следовательно, зависимость увеличения массы от времени для окисления кальция при Т = 773 К выражается линейным законом
ч, следовательно, зависимость увеличения массы от времени для окисления кальция при Т = 773 К выражается линейным законом 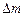 = 19,3
= 19,3 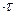 г/м2. Линейный закон указывает на то, что скорость роста пленки контролируется кристаллохимическим превращением металла в оксид. Используя полученное уравнение, рассчитываем удельный прирост массы образца за 50 ч
г/м2. Линейный закон указывает на то, что скорость роста пленки контролируется кристаллохимическим превращением металла в оксид. Используя полученное уравнение, рассчитываем удельный прирост массы образца за 50 ч 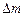 = 19,3
= 19,3  50 = 965 г/м
50 = 965 г/м 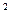 .
.
Пример 2. Найти уравнение зависимости увеличения массы образца железа во времени при выдержке его в воздушной атмосфере при 973 К по экспериментальным данным, представленным в таблице.
| Время, час | |||||
| Увеличение массы, г/м2 |
Установить механизм окисления и рассчитать время, в течение которого прирост массы железа за счет окисления при заданных условиях составит 1,5·103 г/м2.
Решение.
По экспериментальным данным строим график в координатах 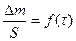 (см. рисунок 7).
(см. рисунок 7).
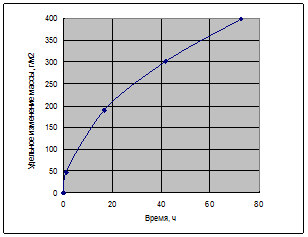
Рисунок 7 – График зависимости 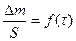
По внешнему виду экспериментальная кривая близка к параболической кривой вида 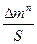 =K· τ,
=K· τ,
где 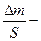 удельное увеличение массы образца, S – площадь поверхности образца, n – показатель степени.
удельное увеличение массы образца, S – площадь поверхности образца, n – показатель степени.
Для нахождения закона роста приведем кинетическое уравнение к виду nlg 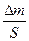 = lgK + lgτ, разделим обе части уравнения на n: lg
= lgK + lgτ, разделим обе части уравнения на n: lg 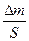 =
= 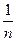 lgK +
lgK + 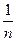 lgτ и построим график в координатах lg
lgτ и построим график в координатах lg 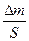 =f(lgτ) (см. рисунок 8)
=f(lgτ) (см. рисунок 8)
| lgτ | - | 0,1 | 1,22 | 1,62 | 1,86 |
lg 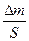
| - | 1,68 | 2,28 | 2,48 | 2,60 |
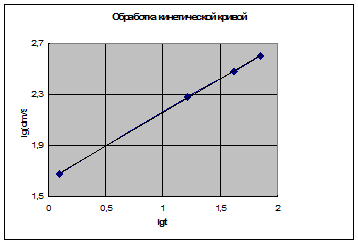
Рисунок 8 – График зависимости lg 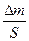 =f(lgτ)
=f(lgτ)
Полученная зависимость описывается уравнением вида lg 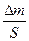 = 1,631 +0,5241 lgτ. Тангенс угла наклона этой линии с осью lgτ представляет собой
= 1,631 +0,5241 lgτ. Тангенс угла наклона этой линии с осью lgτ представляет собой 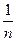 . Следовательно, n = =
. Следовательно, n = = 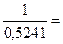 1,91. При lgτ = 0 lg
1,91. При lgτ = 0 lg 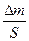 =
= 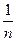 lgK = 1,631. Тогда lgK= = 1,91 ∙ 1,631=3,115, откуда К =1250. Таким образом, зависимость увеличения массы от времени при окислении железа на воздухе при 973 К описывается степенным уравнением вида ∆m1,9 = 1250τ, что указывает на смешанный диффузионно-кинетический контроль процесса.
lgK = 1,631. Тогда lgK= = 1,91 ∙ 1,631=3,115, откуда К =1250. Таким образом, зависимость увеличения массы от времени при окислении железа на воздухе при 973 К описывается степенным уравнением вида ∆m1,9 = 1250τ, что указывает на смешанный диффузионно-кинетический контроль процесса.
Время, в течение которого прирост массы образца железа при заданных режимах окисления составит 1,5·103 г/м2 составит 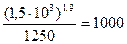 ч.
ч.
Пример 3. Окисление магния в чистом кислороде при высоких температурах протекает по линейному закону. Найти уравнение температурной зависимости константы скорости окисления К магния по данным, приведенным в таблице.
| Температура, К | ||||
| К, г/м2·ч | 0,26 | 0,86 | 2,13 | 5,72 |
Для определения температурной зависимости К воспользуемся уравнением Аррениуса (3.9). Прологарифмируем уравнение Аррениуса: 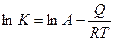 и построим график в координатах
и построим график в координатах 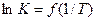 (см. рисунок 9).
(см. рисунок 9).
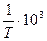 , К-1 , К-1
| 1,289 | 1,252 | 1,214 | 1,179 |
| lnK | -1,347 | -0,151 | 0,756 | 1,742 |
Как видно, график представляет собой прямую линию, тангенс угла наклона которой с осью абсцисс 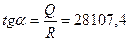 , а отсекаемый отрезок lnА = 34,90 (при Т →∞ lnА = lnK). Из этих уравнений находим значение энергии активации Q = 233573 Дж/моль и предэкспоненциального множителя А =1,43∙1015 г/м2·ч.
, а отсекаемый отрезок lnА = 34,90 (при Т →∞ lnА = lnK). Из этих уравнений находим значение энергии активации Q = 233573 Дж/моль и предэкспоненциального множителя А =1,43∙1015 г/м2·ч.

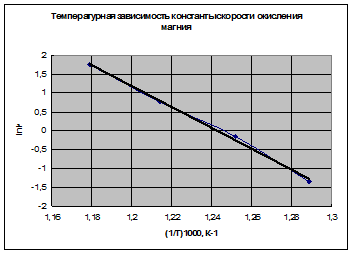
Рисунок 9 – График зависимости 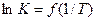
Таким образом, уравнение температурной зависимости константы скорости окисления магния в чистом кислороде можно представить следующим образом 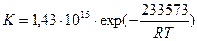 , г/(м2·ч).
, г/(м2·ч).
На основании этого уравнения, например можно определить увеличение массы Mg после 20 ч окисления его в чистом кислороде при 813 К.
Рассчитаем значение константы К для данной температуры 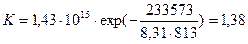 г/(м2·ч). Изменение массы при линейном законе составит
г/(м2·ч). Изменение массы при линейном законе составит 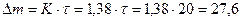 г/м2.
г/м2.
Дата добавления: 2015-07-11; просмотров: 378 | Нарушение авторских прав