
Читайте также:
|
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролитами называются вещества, водные растворы или расплавы которых проводят электрический ток. Согласно теории электролитической диссоциации эти вещества в растворах или расплавах распадаются (диссоциируют) на заряженные частицы - ионы. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Возможность и степень распада вещества на ионы определяется природой растворенного вещества и растворителя. Электролиты представляют собой соединения, образованные за счет ионной или ковалентной полярной связи. Когда кристалл соли, например хлорид калия, попадает в воду, расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольные взаимодействия). К катионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-анионам – положительными (рис 2.1.).
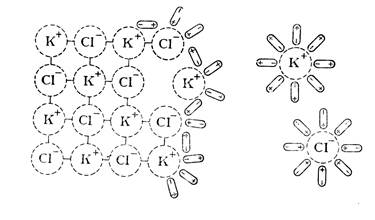
Рис.2.1. Схема растворения соли
Иначе протекает диссоциация полярных молекул (рис.2.2.). Молекулы воды, притянувшиеся к полюсам полярной молекулы (диполь-дипольное взаимодействие), дополнительно поляризуют молекулу. Такая поляризация в сочетании с тепловым движением окружающих молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае ионного кристалла, эти ионы гидратируются.

Рис.2. 2.Схема диссоциации полярных молекул в растворе
Согласно закону Кулона сила взаимодействия F двух зарядов е1 и е2, находящихся на расстоянии r друг от друга, выражается уравнением F =  ,
,
где e - диэлектрическая проницаемость среды, в которой находятся заряды; она показывает, во сколько раз сила взаимодействия между зарядами в данной среде меньше, чем в вакууме (eвакуума =1).
Диэлектрическая проницаемость воды eH2O = 80,1; этилового спирта eC2H5OH = 25,2; бензола eC6H6 = 2,3. Чем больше e растворителя, тем слабее притягиваются друг к другу противоположно заряженные ионы и тем интенсивнее идет диссоциация электролита на ионы.
Дата добавления: 2015-07-10; просмотров: 112 | Нарушение авторских прав