
Читайте также:
|
Вода является очень слабым электролитом, диссоциирующим по уравнению Н2О «Н++ ОН-.
Константа диссоциации воды при 22О С равна:
Kд =  = 1,8 × 10-16.
= 1,8 × 10-16.
Доля молекул воды, диссоциированных на ионы, настолько мала, что концентрацию недиссоциированных молекул можно считать постоянной и равной числу молей воды в литре, т.е.
[H2O] =  = 55,56 моль / л.
= 55,56 моль / л.
(Напомним, что молярная масса воды равна18 г/моль.)
Подставив это значение в выражение константы диссоциации и перенеся его в правую часть, получим
[H+] × [OH-] = 1,8 × 10-16 × 55,56 = 10-14.
Эта постоянная величина называется ионным произведениемводы (КН2О); она не зависит от присутствия в воде других ионов (но зависит от температуры). Всякий водный раствор, как и чистая вода, содержит ионы Н+и ОН-и ни в каком случае [H+] или [OH-] не могут быть равны нулю, так как при этом их произведение должно обратиться в нуль.
При растворении в воде какой-либо кислоты концентрация катионов водорода [H+] увеличивается, а концентрация [OH-] должна понизиться, и наоборот. Величина ионного произведения при этом постоянная [H+] × [OH-] = 10-14.
При диссоциации чистой воды [H+] = [OH-] = 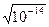 = 1 × 10-7моль / л.
= 1 × 10-7моль / л.
В кислой среде [H+] > [OH-], [H+] > 1. 10-7 моль/л и соответственно [OH-] < 1. 10-7 моль/л. Например, при [HCl] = 0,1 моль/л рН = 1.
В щелочной среде [H+] < [OH-], [H+] < 1. 10-7 моль/л и соответственно [OH-] > 1. 10-7 моль/л. Например, при [KOH] = 0,1 моль/л рН = 13.
2.9. Водородный показатель среды (рН)
Воспользовавшись одной из величин [H+] или [OH-], можно количественно охарактеризовать кислотные и щелочные свойства растворов. Обычно для этого используют концентрацию катионов водорода [Н+], но эта величина выражается дробными и часто очень малыми числами, которыми неудобно оперировать. Поэтому для количественной характеристики кислотности или щелочности раствора пользуются особой величиной, называемой водородным показателем рН:
pH = - lg [H+].
Тогда для нейтральной среды рН = 7, для кислотной среды pH < 7, для щелочной среды рН > 7.
В табл. 2.1. показана взаимосвязь концентраций ионов Н+, ОН-и рН в кислых и щелочных растворах.
Таблица 2.1
Водородный показатель растворов
| Концентра- ция ионов | Усиление щелочных свойств ------------------------- | Нейтраль-ная среда | Усиление кислотных свойств ---------------------® |
| [OH-] | 1(10O) 10-2 10-4 10-6 | 10-7 | 10-8 10-10 10-12 10-14 |
| [H+] | 10-14 10-12 10-10 10-8 | 10-7 | 10-6 10-4 10-2 10O |
| рH | 14 12 10 8 | 6 4 2 0 |
Простым методом оценки величины рН является метод, основанный на применении индикаторов - веществ, изменяющих свою окраску в зависимости от концентрации ионов Н+, т.е. величины рН раствора.
Изменение окраски каждого индикатора наблюдается только в некоторых пределах значений рН (табл.2.2).
Интервал значений рН, в котором окраска индикатора изменяется в соответствии с изменением рН, называется областью перехода или интервалом индикатора.
Таблица 2.2
Важнейшие индикаторы
| Название индикатора | Цвет при значении рН ниже интервала индикатора | Интервал индикатора рН | Цвет при значении рН выше интервала индикатора |
| Метилоранж | красный | 3,2 - 4,4 | желтый |
| Метилрот | красный | 4,2 - 6,2 | желтый |
| Лакмус | красный | 5,0 - 8,0 | синий |
| Фенолрот | желтый | 6,8 - 8,2 | красный |
| Фенолфталеин | бесцветный | 8,2 - 10,0 | малиновый |
На практике определение рН сводится к тому, что к исследуемому раствору добавляется индикатор и полученная окраска раствора сравнивается с окраской эталонных растворов серии, содержащей тот же индикатор или с эталонами цветной шкалы, где указан рН для каждого эталона. Вместо раствора индикатора часто применяют пропитанные им полоски фильтровальной бумаги. Эти полоски смачивают раствором, рН которого необходимо определить, и сравнивают образующуюся окраску со шкалой.
Приведем несколько примеров вычисления рН по концентрации ионов водорода и, наоборот, расчета концентрации ионов водорода по известному значению рН.
В разбавленных растворах сильных кислот и оснований типа НCl, HNO3, KOH, NaOH молярная концентрация ионов водорода и гидроксил-ионов совпадает с молярной концентрацией кислоты или основания. Поэтому в 0,001М растворе НCl концентрация ионов водорода [H+]=0,001 моль/л и рН = - lg0,001 = 3. В 0,001М растворе КОН концентрация гидроксил-ионов равна [OH-] = 0,001 моль/л, значит, [H+]=  моль/л и рН = -lg 10-11= 11.
моль/л и рН = -lg 10-11= 11.
Дата добавления: 2015-07-10; просмотров: 147 | Нарушение авторских прав