
|
Читайте также: |
Диссоциация электролита количественно характеризуется степенью диссоциации. Степень диссоциации a – это отношение числа молекул, диссоциированных на ионы Nдис, к общему числу молекул растворенного электролита N: a = 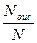 .
.
a - доля молекул электролита, распавшихся на ионы. Например, если из каждых 100 молекул растворенного вещества 82 распадаются на ионы, то степень диссоциации соединения будет равна:
a = 0,82 или a = 82%.
Как следует из определения, для расчета степени диссоциации вещества необходимо знать число частиц (или молей), получающихся при диссоциации его в растворе. Это число может быть определено измерением понижения давления пара над раствором Δр по отношению к чистому растворителю.
Степень диссоциации электролита зависит от многих факторов:
-природы электролита;
-природы растворителя (диссоциация происходит лишь в полярных растворителях, обладающих высокой диэлектрической проницаемостью);
-концентрации раствора;
-температуры.
По способности к диссоциации электролиты условно разделяют на сильные и слабые. Электролиты, которые в растворе существуют только в виде ионов, принято называть сильными. Те электролиты, которые в растворенном состоянии находятся частично в виде молекул и частично в виде ионов, называются слабыми.
К сильным электролитам относятся почти все соли, некоторые кислоты: H2SO4, HNO3, HCl, HJ, HClO4, гидроксиды щелочных и щелочно-земельных металлов (табл.1, прил. 2.16).
Процесс диссоциации сильных электролитов идет до конца: HNO3 = H++ NO3- ,
NaOH = Na++ OH-.
и в уравнениях диссоциации ставятся знаки равенства.
Применительно к сильным электролитам понятие "степень диссоциации" носит условный характер. "Кажущаяся" степень диссоциации ( a каж.), определяемая на опыте, ниже истинной (табл.2, прил. 2.16.). С увеличением концентрации сильного электролита в растворе усиливается взаимодействие разноименно заряженных ионов. При достаточном приближении друг к другу они образуют ассоциаты. Ионы в них разделены слоями полярных молекул воды, окружающих каждый ион. Это сказывается на уменьшении электропроводности раствора, измеряемого приборами, т.е. создается эффект неполной диссоциации. Для учета этого эффекта введен коэффициент активности g, который уменьшается с возрастанием концентрации раствора, изменяясь в пределах от 0 до 1.
Для количественного описания свойств растворов сильных электролитов пользуются величиной, называемой активностью a.
Под активностью иона понимают ту эффективную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона a равна его молярной концентрации С, умноженной на коэффициент активности:
а = gС.
Использование активности вместо концентрации позволяет применять к растворам закономерности, установленные для идеальных растворов.
К слабым электролитам относятся некоторые минеральные (HNO2, H2SO3, H2S, H2SiO3, HCN, H3PO4) и большинство органических кислот (СН3СООН, Н2С2О4 и др.), гидроксид аммония NH4OH и все малорастворимые в воде основания, органические амины.
Диссоциация слабых электролитов обратима. В растворах слабых электролитов устанавливается равновесие между ионами и недиссоциированными молекулами. В соответствующих уравнениях диссоциации ставится знак обратимости («). Например, уравнение диссоциации слабой уксусной кислоты записывается так:
CH3COOH «CH3COO-+ H+.
В растворе слабого бинарного (диссоциирующего на два иона) электролита (КА) устанавливается следующее равновесие, характеризуемое константой равновесия, называемой константой диссоциации Кд:
КА «К+ + А-,
КД = 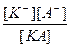 .
.
Если в 1 л раствора растворено С молей электролита и степень диссоциации равна a, значит, продиссоциировало aС молей электролита и образовалось каждого иона по aС молей. В недиссоциированном состоянии остается (С - aС) молей КА.
КА «К+ + А-,
С -aС aС aС.
Тогда константа диссоциации будет равна:
КД = 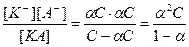 . (2.1)
. (2.1)
Так как константа диссоциации не зависит от концентрации, то выведенное соотношение выражает зависимость степени диссоциации слабого бинарного электролита от его концентрации. Из уравнения (2.1) видно, что уменьшение концентрации слабого электролита в растворе приводит к росту степени его диссоциации. Уравнение (2.1) выражает закон разведения Оствальда.
Для очень слабых электролитов (при a << 1), уравнение Оствальда можно записать следующим образом:
Кд» a2C, или a» 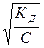 . (2.2)
. (2.2)
Константа диссоциации для каждого электролита постоянна при данной температуре, она не зависит от концентрации раствора и характеризует способность электролита диссоциировать на ионы. Чем выше Кд, тем в большей степени электролит диссоциирует на ионы. Константы диссоциации слабых электролитов сведены в таблицы (табл 3, прил.2.16).
Дата добавления: 2015-07-10; просмотров: 263 | Нарушение авторских прав