
Читайте также:
|
Таблица 3. Исходные данные к заданию 3.
| № вар. | Электролит |  кДж/моль
кДж/моль
| № вар. | Электролит |  кДж/моль
кДж/моль
|
| AgBr | Hg2Cl2 | ||||
| AgI | Hg2Br2 | ||||
| AgIO3 | -92 | Hg2I2 | -111 | ||
| AgCN | Hg2SO4 | ||||
| Ag2SO4 | Ni(OH)2 | -459 | |||
| Ag2CrO4 | -635 | PbBr2 |  =-24 кДж/моль =-24 кДж/моль
| ||
| Ag2S | PbI2 | ||||
| Ca(OH)2 | PbSO4 | ||||
| CdCO3 | -674 | PbS | |||
| Cd(OH)2 | -474 | TlCl | |||
| Co(OH)2 | -456 | TlI | -125 | ||
| CuCl | Zn(OH)2 | ||||
| CuI | -70 | ZnS | |||
| Fe(OH)2 | -493 | Ca(OH)2 |
Примечание. В табл. 3 приведены стандартные энергии Гиббса образования веществ, отсутствующие в ²Кратком справочнике…².
Таблица 4. Исходные данные к заданию 4.
| № ваp. | A | B | M1 | C | D | M2 | а (A) | a (B) | a (C) | a (D) |
| Cu2+ | — | Cu | Br2(ж) | Br– | Pt | 0,02 | — | 0,03 | ||
| Cu2+ | — | Cu | O2 | OH– | Pt | 0,03 | — | 1,5 | 0,02 | |
| Cr3+ | — | Cr | Cl2 | Cl– | Pt | 0,05 | — | 1,2 | 0,02 | |
| Fe3+ | Fe2+ | Pt | Cr3+ | Cr2+ | Pt | 0,005 | 0,15 | 0,1 | 0,001 | |
| Fe(CN)63– | Fe(CN)64– | Pt | Co3+ | Co2+ | Pt | 0,06 | 0,06 | 0,04 | 0,005 | |
| Ag+ | — | Ag | Ag2O | OH– | Ag | 0,04 | — | 0,03 | ||
| Co3+ | Co2+ | Pt | Fe(CN)63– | Fe(CN)64– | Pt | 0,04 | 0,009 | 0,06 | 0,001 | |
| H+ | H2 | Pt | O2 | OH– | Pt | 0,04 | 1,5 | 0,5 | 0,06 | |
| H+ | H2 | Pt | Cl2 | Cl– | Pt | 0,05 | 0,6 | 0,5 | 0,02 | |
| Cl2 | Cl– | Pt | AgCl | Cl– | Ag | 1,5 | 0,04 | 0,04 | ||
| AgI | I– | Ag | AgCl | Cl– | Ag | 0,02 | 0,06 | |||
| Cu2+ | Cu+ | Pt | Sn4+ | Sn2+ | Pt | 0,14 | 0,009 | 0,002 | 0,08 | |
| H3AsO4 | HAsO2 | Pt | MnO4– | MnO42– | Pt | 0,08 | 0,04 | 0,02 | 0,007 | |
| V3+ | V2+ | Pt | Tl3+ | Tl+ | Pt | 0,016 | 0,007 | 0,001 | 0,1 | |
| Hg22+ | Hg | Pt | Cl2 | Cl– | Pt | 0,04 | 0,8 | 0,06 | ||
| H3AsO4 | HAsO2 | Pt | V3+ | V2+ | Pt | 0,15 | 0,005 | 0,005 | 0,01 | |
| O2 | OH– | Pt | AgI | I– | Ag | 1,5 | 0,05 | 0,04 | ||
| H2 | OH– | Pt | O2 | OH– | Pt | 2,0 | 0,02 | 0,8 | 0,02 | |
| Ag+ | — | Ag | S2O62– | SO42– | Pt | 0,02 | — | 0,07 | 0,03 | |
| Ag2SO4 | SO42– | Ag | V3+ | V2+ | Pt | 0,02 | 0,01 | 0,02 | ||
| PbBr2 | Br– | Pb | S2O62– | SO42– | Pt | 0,005 | 0,005 | 0,03 | ||
| MnO4– | MnO42– | Pt | Mn2+ | MnO4– | Pt | 0,009 | 0,014 | 0,07 | 0,009 | |
| Mn2+ | MnO4– | Pt | Sn4+ | Sn2+ | Pt | 0,01 | 0,02 | 0,08 | 0,15 | |
| Fe3+ | Fe2+ | Pt | I3– | I– | Pt | 0,02 | 0,03 | 0,01 | 0,04 | |
| Ni2+ | — | Ni | I3– | I– | Pt | 0,01 | — | 0,03 | 0,06 | |
| Hg22+ | Hg | Pt | AgBr | Br– | Ag | 0,08 | 0,01 | |||
| MnO4– | MnO42– | Pt | Fe3+ | Fe2+ | Pt | 0,018 | 0,005 | 0,15 | 0,05 | |
| PbSO4 | SO42– | Pb | Br2(ж) | Br– | Pt | 0,05 | 0,05 |
Примечание. В таблице 4 введены следующие обозначения: М1 и М2 – металлические электроды; A, B, C, D – ионы или молекулы, присутствующие в приэлектродном электролите; a (A), a (B), a (C), a (D) – соответствующие активности. Активность воды принимается равной единице. В вариантах, номера которых обведены рамкой №, активность протонов a (H+) принять равной 0,2.

Таблица 5. Исходные данные к заданию 5.
| № вар. | Уравнение реакции | 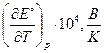
|
Zn + 2AgCl  ZnCl2 + 2Ag ZnCl2 + 2Ag
| -7,57 | |
Zn + Hg2SO4  ZnSO4 + 2Hg ZnSO4 + 2Hg
| -9,48 | |
Cd + Hg2SO4  CdSO4 + 2Hg CdSO4 + 2Hg
| -7,95 | |
Cd + 2AgCl  CdCl2 + 2Ag CdCl2 + 2Ag
| -6,04 | |
Cd + PbCl2  CdCl2 + Pb CdCl2 + Pb
| -4,16 | |
Zn + Hg2Cl2  ZnCl2 + 2Hg ZnCl2 + 2Hg
| -4,13 | |
Pb + 2AgI  PbI2 + 2Ag PbI2 + 2Ag
| -1,83 | |
2Hg + 2AgCl  Hg2Cl2 + 2Ag Hg2Cl2 + 2Ag
| -3,44 | |
Pb + Hg2Cl2  PbCl2 + 2Hg PbCl2 + 2Hg
| 1,57 | |
Mg + 2HCl  MgCl2 + H2 MgCl2 + H2
| -1,13 | |
2Cu + I2  2CuI 2CuI
| 0,60 | |
2FeCl3 + H2  2FeCl2 + 2HCl 2FeCl2 + 2HCl
| 11,88 | |
Fe + NiCl2  FeCl2 + Ni FeCl2 + Ni
| 0,80 | |
2Al + Cr2(SO4)3  Al2(SO4)3 + 2Cr Al2(SO4)3 + 2Cr
| -3,13 | |
Pb + Ag2S  PbS + 2Ag PbS + 2Ag
| -1,66 | |
Pb + I2  PbI2 PbI2
| -0,29 | |
2Cr + 3SnCl2  2CrCl3 + 3Sn 2CrCl3 + 3Sn
| -4,28 | |
Cu + 2AgNO3  Cu(NO3)2 + 2Ag Cu(NO3)2 + 2Ag
| -9,72 | |
3Zn + 2CrCl3  3ZnCl2 + 2Cr 3ZnCl2 + 2Cr
| 0,37 | |
Pb + Cu(CH3COO)2  Cu + Pb(CH3COO)2 Cu + Pb(CH3COO)2
| 1,90 | |
Fe + CuSO4  FeSO4 + Cu FeSO4 + Cu
| -0,76 | |
AgNO3 + Fe(NO3)2  Fe(NO3)3 + Ag Fe(NO3)3 + Ag
| -21,84 | |
2Cr + 3Cl2  2CrCl3 2CrCl3
| -13,94 | |
2Hg + Ag2SO4  Hg2SO4 + 2Ag Hg2SO4 + 2Ag
| -3,42 | |
2Hg + 2AgCl + H2SO4  Hg2SO4 + 2Ag + 2HCl Hg2SO4 + 2Ag + 2HCl
| 1,91 | |
Cd + Hg2Cl2  CdCl2 + 2Hg CdCl2 + 2Hg
| -2,60 | |
2Ag + Cl2  2AgCl 2AgCl
| -5,99 | |
Zn + CuSO4  ZnSO4 + Cu ZnSO4 + Cu
| -1,37 |
Рассмотрим выполнение каждого задания на примерах.
Дата добавления: 2015-07-10; просмотров: 167 | Нарушение авторских прав