
Читайте также:
|
Выполнение задания 4 рассмотрим для следующих исходных данных:
| A | B | M1 | C | D | M2 | a (A) | a (B) | a (C) | a (D) |
| Cr2O72– | Cr3+ | Pt | O2 | H+ | Pt | 0,01 | 0,05 | 0,5 | 0,1 |
Составим формулы электродов и электрохимической цепи. В нашем примере формулы электродов записывают так:
Cr2O72–, Cr3+ôPt
H+, H2OôO2ôPt
Схема электрохимической цепи, составленной из этих электродов:
PtôO2ôH+, H2OôôCr2O72–, Cr3+ôPt
2) Реакции, протекающие на электродах, и уравнение реакции для электрохимической цепи в целом имеют следующий вид:
2×½ Cr2O72– + 14H+ + 6e–  2Cr3+ + 7H2O,
2Cr3+ + 7H2O,
–
3×½ O2 + 4H+ + 4e–  2H2O,
2H2O,
––––––––––––––––––––––––––––––––––––
2Cr2O72– + 16H+  4Cr3+ + 3O2 + 8H2O
4Cr3+ + 3O2 + 8H2O
3) ЭДС электрохимической цепи рассчитаем по уравнению Нернста:
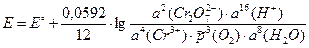
Стандартную ЭДС найдем по определению (3.1) как разность стандартных электродных потенциалов правого и левого электродов:
E° = j°прав – j°лев = 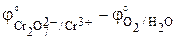 = 1,33 – 1,229 = 0,10 В.
= 1,33 – 1,229 = 0,10 В.
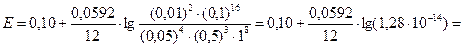
= 0,10 – 0,07 = 0,03 В.
4) Изменение стандартной энергии Гиббса в ходе электрохимической реакции вычислим по уравнению (3.4):
DG° = – zFE° = – 12×96485 Кл/моль×0,101 В = – 116940 Дж/моль.
Аналогичное уравнение справедливо также для нестандартных условий:
DG = – zFE = – 12×96485 Кл/моль×0,03 В = – 37050 Дж/моль.
5) Константу равновесия можно выразить из уравнения (3.3) для стандартного химического сродства:
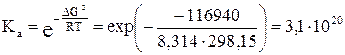
Для изменения направления тока на обратное необходимо, чтобы E ≤ 0:
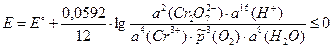
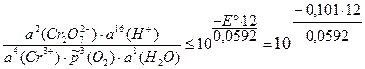 = 3,4×10–21.
= 3,4×10–21.
Дата добавления: 2015-07-10; просмотров: 70 | Нарушение авторских прав