
Читайте также:
|
Рассчитаем величины, указанные в задании 1, для водного раствора перхлората магния с моляльной концентрацией m = =3,0 моль/кг воды.
1) Запишем уравнение реакции электролитической диссоциации перхлората магния:
Mg(ClO4)2 = Mg2+ + 2ClO4–
Примем, что при растворении в воде данное вещество диссоциирует на ионы нацело и необратимо, поскольку оно является сильным электролитом. Следовательно, концентрация ионов магния равна, а концентрация перхлорат-ионов вдвое больше аналитической концентрации перхлората магния: m (Mg2+) = m (Mg(ClO4)2) = m, m (ClO4–) = 2∙ m (Mg(ClO4)2) = 2 m.
Таким образом, ионная сила I водного раствора тетраоксохлората(VII) магния согласно формуле (1.3) будет выражаться так:
 моль/кг воды.
моль/кг воды.
2) Среднюю ионную моляльность m± вычислим по уравнению (1.2):
m ±(Mg(ClO4)2) = 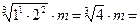 1,587×3,0 = 4,76 моль/кг воды.
1,587×3,0 = 4,76 моль/кг воды.
3) Среднюю ионную активность a ± рассчитаем по формуле (1.4), в которую подставим справочное значение среднего ионного моляльного коэффициента активности g ± для перхлората магния:
g ±(Mg(ClO4)2) = 9,19 [²Краткий справочник…², табл. 72, стр. 131].
a ±(Mg(ClO4)2) = 9,19 ×4,76/1 = 43,76.
4) Общую активность a электролита найдем в соответствии с формулой (1.5):
а (Mg(ClO4)2) = (43,76)3 = 8,380×104.
Дата добавления: 2015-07-10; просмотров: 75 | Нарушение авторских прав