
Читайте также:
|
Найдем ПР(AgCl) при 25 °С.
Способ 1. Составим электрохимическую цепь из серебряного и хлорсеребряного электродов:
AgôAgClôKCl(нас.)ôôAgNO3ôAg
Электроды выбирают таким образом, чтобы суммарная реакция в электрохимической цепи выражала равновесный процесс растворения малорастворимого сильного электролита.
Рассмотрим приведенную выше электрохимическую систему как концентрационную серебряную цепь.
Тогда на каждом электроде протекает реакция:
Ag+ + e–  Ag
Ag
Потенциал каждого электрода выражается уравнением Нернста:
j(Ag+/Ag) = j°(Ag+/Ag) + 0,0592× lga (Ag+)
Однако на левом электроде ионы серебра образуются при диссоциации хлорида серебра, и их активность связана с произведением растворимости этого электролита. Поскольку хлорид серебра находится в концентрированном растворе хлорида калия, активность ионов серебра удобно выразить через активность хлорид-ионов:

Тогда выражение для потенциала левого электрода можно представить в таком виде:
jлев= j°(Ag+/Ag) + 0,0592×lg  =
=
= j°(Ag+/Ag) + 0,0592× lg ПР(AgCl) + 0,0592×lg 
С другой стороны, поскольку на левом электроде ионы серебра связаны с реакцией: Ag+ + Cl–  AgCl, то весь процесс на нем можно представить так:
AgCl, то весь процесс на нем можно представить так:
Ag+ + e–  Ag,
Ag,
–
Ag+ + Cl–  AgCl,
AgCl,
––––––––––––––––––
AgCl + e–  Ag + Cl–
Ag + Cl–
Для последней реакции, полученной при вычитании из первого уравнения второго, уравнение для электродного потенциала соответствует уравнению Нернста для хлорсеребряного электрода:
jлев= j°(AgCl/Ag) + 0,0592×lg  .
.
Сравнивая два выражения для потенциала левого электрода, приходим к уравнению, связывающему ПР(AgCl) со стандартными электродными потенциалами:
j°(AgCl/Ag) = j°(Ag+/Ag) + 0,0592× lg ПР(AgCl)
Окончательно получаем расчетную формулу для вычисления произведения растворимости хлорида серебра:
ПР(AgCl) = 
j°(AgCl/Ag) = 0,222 В, j°(Ag+/Ag) = 0,799 В [²Краткий справочник…², табл. 79, стр. 143 – 147].
ПР(AgCl) = 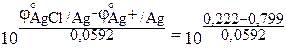 = 1,79×10–10.
= 1,79×10–10.
Растворимость представляет собой концентрацию растворенного вещества в его насыщенном растворе.
Для труднорастворимых сильных электролитов в выражении для произведения растворимости произведение активностей можно заменить произведением молярных концентраций.
В общем случае для равновесия растворения труднорастворимого сильного электролита
MmAa(кр) 

выражение для произведения растворимости имеет вид:
ПР(MmAa) =  = (mc)m×(ac)a = mm×aa×cm+a,
= (mc)m×(ac)a = mm×aa×cm+a,
где с – молярная концентрация электролита в его насыщенном растворе, которая выражается так:
с(MmAa) = 
Для 1,1-зарядного электролита MA:
c(MA) = 
S(AgCl) =  =1,34×10–5 моль/л.
=1,34×10–5 моль/л.
Таким образом, растворимость хлорида серебра в воде при 25 °С составляет 1,34×10–5 моль/л.
Способ 2. Произведение растворимости можно также рассчитать по известным значениям стандартной энергии Гиббса образования ионов в водных растворах при 25 °С.
Так, для равновесия растворения хлорида серебра
Ag+(р) + Cl–(р)  AgCl(кр)
AgCl(кр)
значения DfG° при 298,15 К следующие [²Краткий справочник…², табл. 44, стр. 89 – 91]:
| Ион | Ag+(р) | Cl–(р) |
 , кДж/моль , кДж/моль
| 77,10 | –131,29 |
В том же справочнике находим  (AgCl(кр)) = –109,54 кДж/моль.
(AgCl(кр)) = –109,54 кДж/моль.
Рассчитаем изменение стандартной энергии Гиббса в ходе рассматриваемой реакции:
 =
=  (AgCl(кр)) –
(AgCl(кр)) –  (Ag+(р)) –
(Ag+(р)) –  (Cl–(р)) =
(Cl–(р)) =
= –109,54 – 77,10 – (–131,29) = –55,35 кДж/моль.
Запишем уравнение для стандартного химического сродства:
DrG° = – RT ln Kа
Выражение константы равновесия через активности ионов:
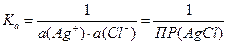
Следовательно,
DrG° = RT · ln ПР(AgCl)
Откуда выражаем произведение растворимости:
ПР(AgCl) =  2,01·10–10.
2,01·10–10.
Дата добавления: 2015-07-10; просмотров: 140 | Нарушение авторских прав