
Читайте также:
|
Ввиду того, что диазокетоны 1 и 2 были получены впервые, и поскольку предполагалось, что они будут обладать различной реакционной способностью в фотохимических реакциях, нами была предпринята попытка оценить структурные отличия региоизомеров 1 и 2 с помощью спектральных методов – ИК спектроскопии, спектроскопии ЯМР 1Н, 13С, а также рентгеноструктурного анализа.
Наиболее существенные отличия в ИК спектрах диазокетонов 1а-в и 2а-в наблюдаются в положении полос поглощения валентных колебаний карбонильных групп (Табл.1).


Схема 7
Таблица 1.
| X | νCO, см-1 (KBr) 1 2 | ∆ | δCO, м.д. 1 2 | ∆ | ||
| F Н ОМе | 196.9 197.0 197.7 | 192.6 192.7 193.7 | 4.3 4.3 4.0 | |||
| νCN2,см-1 | δCN2, м.д. | |||||
| F Н ОМе | -20 -2 | 64.8 64.4 65.2 | 65.9 65.3 65.5 | -1.1 -0.9 -0.3 |
При переходе от диазокетонов 1а-в к их региоизомерам 2а-в с двумя арильными заместителями при карбонильной группе наблюдается заметное смещение полосы поглощения ν СО в сторону более низких частот. Несколько меньшее, но тоже заметное смещение происходит в положении полосы поглощения валентных колебаний ν СN2 диазогруппы (Табл.1).
Аналогичная картина наблюдается в спектрах ЯМР 13С региоизомерных диазокетонов 1 и 2 при переходе от диазокетонов 1а-в к 2а-в, несущих два арильных заместителя при карбонильной группе, где наблюдается значительное смещение углеродного сигнала С=О группы в более сильное поле (более 4м.д.) (Табл. 1). Одновременно сигнал диазоуглеродного атома, как и следовало ожидать при образовании водородной связи с О-атомом карбонильной группы, в смещается, хоть и в меньшей степени, в более слабое поле (~ на 1 м.д.).
Такие изменения в спектрах характерны для карбонильных соединений, образующих внутри и межмолекулярные водородные связи [48]. Следует отметить, что, в отличие от классических Н-связей, которые давно известны и хорошо изучены [48], существование аналогичных взаимодействий H-атомов арильных ядер c О-, N-акцепторными группами до недавнего времени считалось маловероятным. Однако в течение двух последних десятилетий появились многочисленные экспериментальные свидетельства в пользу существования СAr-H…O водородных связей, особенно в биологических системах, которые нашли свое отражение в десятках публикаций, включая несколько обзоров, посвященных этому вопросу [49-52].
Таким образом, на основании полученных нами экспериментальных данных и литературных аналогий можно заключить, что у диазокетонов 2а-в, имеющих два арильных заместителя в α -положении к группе С=О, реализуются слабые внутримолекулярные взаимодействия между орто -Н-атомами арильного ядра и неподеленными электронными парами атома кислорода карбонильной группы, что и приводит к наблюдаемым изменениям в ИК и ЯМР 13С спектрах рассматриваемых диазокетонов (Рис. 1; 2а).
 2а
2а
|
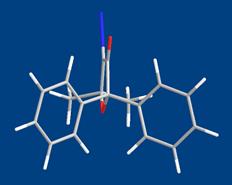 2в
2в
|
| Рис. 1 |
Дополнительным аргументом в пользу этого предположения можно считать результаты расчета геометрии диазокетона 2в, которые показывают, что мета -С-Н связи обоих арильных колец молекулы ориентированы в сторону кислородного атома группы С=О и расстояние между атомами CArН…О=С согласно этим данным составляет 2.36 Å (Рис. 1; 2в). Рассчитанные для аналогичных, но межмолекулярных водородных CArН…ОH2 связей бензола или орто -C-H-атомов фенола с кислородным атомом Н2О это расстояние оценивается в 3.3-3.4 Å, тогда как в случае классических Н…О- и N-связей оно составляет 2.8-2.9Å [52а ].
 Структура 2впо данным РСА
Структура 2впо данным РСА
|  Структура 1а по данным РСА
Структура 1а по данным РСА
|
Рис. 2
Принципиально ту же самую картину дает рентгеноструктурный анализ региоизомера 2в (Х = Н) [53] (Рис. 2). Согласно полученным рентгеноструктурным данным расстояние между орто -протонами арильных ядер (H15 и H9) и кислородным атомом карбонильной группы (О4) в кристалле диазокетона 2в составляет 2.47Å, что хорошо согласуется с расчетными данными оптимизированной геометрии диазокетона 2а (2.36Å) и литературными данными для межмолекулярных мета -CAr-Н…O=C водородных связей у пара -Cl-пропиофенона в кристаллическом состоянии (2.46-2.48Å) [52б].
Литература
48. а) Пиментел Дж., Мак-Клеллан О. Водородная связь. Изд. Мир, М., 1964, 147, 168; б) Водородная связь. Ред. Соколов Н.Д., Чулановский В.М. Изд. Наука, М., 1964, 339 с.
49. а) Steiner Th. C-H…O Hydrogen Bonding in Crystals. Crystal. Rev., 1996, 6, 1-57; б) Hobza, P.; Havlas, Z. Chem.Rev. 2000, 100, 4253.
50. Desiraju G.R. The C-H…O hydrogen bond: structural implications and supramolecular design. Acc. Chem. Res., 1996, 29, 441–449.
51. Jeffrey G.A., Maluszynska H., Mitra J. Int. J. Biol. Macromol., 1985, 7, 336-348.
52. а) Scheiner S., Kar T., Pattanayak J., J. Am. Chem. Soc., 2002, 124, 13257; б) Cox P.J. Acta Cryst. 2002, E58, o661; в) Olson C.A., Shi Z., Kallenbach N.R. J. Am. Chem. Soc., 2001, 123, 6451; г) Scheiner S., Kar T., Gu Y., J. Biol. Chem., 2001, 276, 9832; д) Samanta U., Pal D. Proteins: Struct., Funct., Genet. 2000, 38, 288; Hakansson K. Int. J. Biol. Macromol., 1996, 18, 189, и многие другие.
53. Malashikhin S.A., Nikolaev V.A., Rodina L.L., A. Linden, H. Heimgartner, Helv. Chim. Acta., 2008, в печати.
2.3. Термические превращения региоизомерных диазокетонов 1а, 2а (X = F)
Фотохимические реакции циклических диазокетонов во многих случаях приводят к тем же результатам, что и термолиз [41,42,45а,б]. В связи с этим, прежде чем приступить к изучению фотохимических превращений изомерных диазокетонов 1 и 2 мы провели опыты по выяснению их термической устойчивости и направления термических превращений. Эти реакции изучали на примере термолиза диазокетонов 1а и 2а с пара - F -заместителем в арильных ядрах в растворе ТГФ, диоксане, а также в твердой фазе в вакууме и при обычном давлении.
Оказалось, что оба региоизомера 1а, 2а достаточно стабильны при нагревании до 50-60°, однако при многочасовом кипячении в растворе ТГФ (65 °С, 10ч) и диоксане (102 °С, 10ч), происходит медленное разложение этих диазокетонов с образованием кетена 7, имеющего в спектре 1Н ЯМР отчетливый синглетный сигнал метильных групп при 1.58 м.д. Содержание кетена 7 в реакционной смеси диазокетона 1а через 10 ч составляет 6 % в ТГФ (65°С) и 9% - в диоксане (100°С), а у диазокетона 2а примерно 11 и 12% соответственно. Аналогичная картина наблюдается при возгонке диазокетонов 1а, 2а в вакууме 0.1-0.05 мм.рт.ст.при температуре 65-80°С. В этом случае содержание кетена 7 в возогнанных образцах диазокетонов 1а и 2а достигает 10% и 16% соответственно (Схема 8).

Схема 8
При комнатной температуре интегральная интенсивность сигналов метильных групп при 1.58 м.д. постепенно уменьшается и вместо него появляется один новый сигнал в районе 1.66 м.д., по-видимому, относящийся к димеру кетена 7. Проследить соответствующие изменения в области ароматических протонов не представляется возможным ввиду перекрывания этих сигналов с гораздо более интенсивными мультиплетами протонного спектра исходных диазокетонов 1а и 2а.
Таким образом, при термическом разложении диазокетонов 1а и 2а в растворе и в твердой фазе во время возгонки при температуре выше 60-65 °С происходит их медленное разложение, сопровождающееся перегруппировкой Вольфа и образованием кетена 7. Стерически перегруженный α,α-ди(пара -фторфенил)-α’,α’-диметилкетен 7 сравнительно инертен, но в растворе и в твердой фазе при комнатной температуре медленно превращается в димер.
На основании установленных выходов кетена 7 можно заключить, что региоизомер диазокетона 2а с арильными заместителями при карбонильной группе термически менее стабилен и легче претерпевает разложение с последующей перегруппировкой Вольфа и образованием кетена.
Дата добавления: 2015-10-21; просмотров: 62 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Схема 2 | | | Изучение фотохимических превращений региоизомерных диазокетонов 1а, 2а |