
Читайте также:
|
| І.Організаційний момент. | ||||||||||||||||||
ІІ. Актуалізація знань.
- Що таке ступінь окиснення?
- Йони. Які вони бувають
- Правила визначення ступеня окиснення.
- Що таке окисник?
- Що таке відновник?
- Який процес ми називаємо окиснення?
- Який процес ми називаємо відновлення?
Визначити ступінь окиснення елементів у формулах:
NaOH, CaCO3, NO, H2SO4, H2O, NH3, KMnO4, CaO, Na2SO4,CO2
НРО3, НСlО2, РН3, Н2О2, NaHS, Na2S2O3, H3BO3, Na2S, ClO3, CS2
(Аналіз виконаної роботи, взаємоперевірка)
Які процеси відображають схеми?
а) 

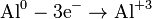
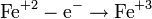 (окиснення)
б) (окиснення)
б) 
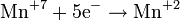

 (відновлення) (відновлення)
| Фронтальне опитування. Робота в зошитах Робота біля дошки | |||||||||||||||||
| ІІІ. Мотивація На планеті Земля постійно відбуваються хімічні перетворення. Окисно-відновні процеси належать до числа найбільш розповсюджених хімічних реакцій і мають величезне значення в теорії і практиці. Окисно-відновні процеси - одні з найважливіших процесів природи. 1. Корозія металів 2. Фейерве́рк 3. Вибух 4. Пожежа 5. Обмін речовин і енергії, або метаболізм. 6. Дихання | ||||||||||||||||||
IV. Вивчення нового матеріалу.
Всі реакції можна поділити на два типи:
1. Реакції, які відбуваються без зміни ступеня окиснення атомів, що входять до складу реагуючих речовин, наприклад: 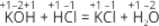 2. Реакції, які відбуваються із зміною ступеня окиснення атомів.
Розглянемо реакцію між двома простими речовинами – натрієм і хлором:
2. Реакції, які відбуваються із зміною ступеня окиснення атомів.
Розглянемо реакцію між двома простими речовинами – натрієм і хлором:
 Натрій і Хлор – прості речовини, ступінь окиснення яких рівний нулю. У результаті сполучення атомів цих речовин утворюється йонна сполука NaCl. Два електрони від двох атомів Натрію перейшли до двох атомів Хлору.
Натрій і Хлор – прості речовини, ступінь окиснення яких рівний нулю. У результаті сполучення атомів цих речовин утворюється йонна сполука NaCl. Два електрони від двох атомів Натрію перейшли до двох атомів Хлору. 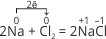 , або Na0 – 1ē → Na+1, Cl0 + 1ē → Cl–1.
Зміна ступеня окиснення пов’язана зі зміною або переходом електронів від одного елемента до іншого.
ü Реакції, які відбуваються зі зміною ступенів окиснення атомів, що входять до складу реагуючих речовин, називають окисно-відновними реакціями.
Розглянемо основні положення теорії окисно-відновних реакцій.
1. Окисненням називають процес віддачі електронів атомом, молекулою або йоном. Атоми, молекули або йони, що віддають електрони, називаютьвідновниками.
Елемент відновник втрачає електрони.
Наприклад: відновник Zn0 – 2ē → Zn+2, процес окиснення. S+4 – 2ē → S+6 S–2 – 8ē → S+6 S–2 – 2ē → S0
Втрата атомом електронів (ē) веде до збільшення позитивного і зменшення негативного заряду.
2. Відновленням називають приєднання електронів атомом, молекулою або йоном. Атоми, молекули або йони, що приєднують електрони, називають окисниками.
Наприклад: окисник S0 + 2ē → S–2, процес відновлення.
Елемент окисник отримує електрони.
Cu+2 + 2ē → Cu0 S+6 + 8ē → S–2 N+5 + 3ē → N+2
Приєднання атомом електронів веде до збільшення негативного і зменшення позитивного заряду.
3. Число електронів, що їх віддає відновник, дорівнює числу електронів, які приєднує окисник.
4. Окиснення завжди супроводжується відновленням, і, навпаки, відновлення завжди пов’язане з окисненням.
Складання рівнянь окисно-відновних реакцій , або Na0 – 1ē → Na+1, Cl0 + 1ē → Cl–1.
Зміна ступеня окиснення пов’язана зі зміною або переходом електронів від одного елемента до іншого.
ü Реакції, які відбуваються зі зміною ступенів окиснення атомів, що входять до складу реагуючих речовин, називають окисно-відновними реакціями.
Розглянемо основні положення теорії окисно-відновних реакцій.
1. Окисненням називають процес віддачі електронів атомом, молекулою або йоном. Атоми, молекули або йони, що віддають електрони, називаютьвідновниками.
Елемент відновник втрачає електрони.
Наприклад: відновник Zn0 – 2ē → Zn+2, процес окиснення. S+4 – 2ē → S+6 S–2 – 8ē → S+6 S–2 – 2ē → S0
Втрата атомом електронів (ē) веде до збільшення позитивного і зменшення негативного заряду.
2. Відновленням називають приєднання електронів атомом, молекулою або йоном. Атоми, молекули або йони, що приєднують електрони, називають окисниками.
Наприклад: окисник S0 + 2ē → S–2, процес відновлення.
Елемент окисник отримує електрони.
Cu+2 + 2ē → Cu0 S+6 + 8ē → S–2 N+5 + 3ē → N+2
Приєднання атомом електронів веде до збільшення негативного і зменшення позитивного заряду.
3. Число електронів, що їх віддає відновник, дорівнює числу електронів, які приєднує окисник.
4. Окиснення завжди супроводжується відновленням, і, навпаки, відновлення завжди пов’язане з окисненням.
Складання рівнянь окисно-відновних реакцій
Підсумок:
| Розповідь вчителя. Запис до зошиту Запис таблиці до зошиту. | |||||||||||||||||
| V. Узагальнення та систематизація знань. 1. Які реакції називаються окисно-відновними? 2. Які типи реакцій можуть відноситись до окисно-відновних реакцій? Наведіть приклади. 3. Що таке окисник і відновник? Які елементи періодичної системи тільки відновники? 4. В яких випадках неметалічні елементи можуть виступати як окисники і як відновники? Наведіть приклад. 5. Чому окисно-відновні реакції – це єдність двох протилежних процесів? 6.Складіть електронний баланс та розставте коефіцієнти в таких оксидно-відновних реакціях: Al + HCl → AlCl3 + H2 FeCl3 + H2S → FeCl2 + HCl + S Fe + HCl → FeCl2 + H2 HI + H2SO4 → I2 + H2S + H2O HgO → Hg + O2 K + H2SO4 → K2SO4 + H2S + H2O 7.У якій сполуці Карбон проявляє ступінь окиснення +2 а) CH4; б) CO; в) CO2; г) K2CO3? 8. Визначіть ступінь окиснення Хлору в сполуках: KCl, KClO, KClO2, KClO4, KClO3. 9.Оксид хімічного елемента I групи головної підгрупи має відносну молекулярну масу 62. Назвіть елемент, складіть формулу його оксиду і гідроксиду. | Питання до учнів Самостійна робота учнів. | |||||||||||||||||
| VІ. Домашнє завдання. Закінчіть окисно-відновні реакції, вкажіть окисник і відновник: KClO3 → KCl + O2 Na + HCl → Fe + CuSO4 → Na + H2O → CH4 + O2 → Zn + H2SO4 → Al + O2 → Zn + CuCl2 → Fe2O3 + CO → Fe + CO2 K + Cl2 → SO2 + O2 → SO3 H2 + Cl2 → | ||||||||||||||||||
| VІІ. Підсумок уроку. Закінчи речення» — Сьогодні на уроці я зрозумів… — Сьогодні на уроці я навчився… — На цьому уроці найцікавішим було… — Від наступного уроку я чекаю… |
Дата добавления: 2015-10-16; просмотров: 128 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Война и мир | | | Тайна, замкнутая в простату |