
|
Читайте также: |
Подобно предмету и его отражению в зеркале, оптические изомеры не могут быть совмещены в пространстве.
Хиральные молекулы открыл в 1848 г. великий французский учёный Луи Пастер. Два типа оптических изомеров органических молекул получили названия D-форма (от лат. dexter — «правый») и L-форма (от лат. laevus — «левый»). Кстати, одно из названий других хиральных молекул — глюкозы и фруктозы — декстроза и левулоза. Примечательно, что в состав белков входят только L-аминокислоты, и вся белковая жизнь на Земле — «левая».
Для нормальной жизнедеятельности организм нуждается в полном наборе из 20 основных a-L-аминокислот. Но одни из них могут быть синтезированы в клетках самого организма, а другие — должны поступать в готовом виде из пищевых продуктов.
В некоторых белках содержатся особые аминокислоты, не входящие в число двадцати стандартных. Они образуются модификацией нормальных аминокислот. Например, в белке соединительной ткани — коллагене найдены 4-гидроксипролин и 5-гидроксилизин. От пролина и лизина они отличаются только гидроксильной группой. Эта группа необходима для образования прочных волокон коллагена. Недостаток такой модификации пролина и лизина в коллагене приводит к развитию цинги.
заменимыми, а во втором — незаменимыми. Набор последних для разных организмов различен. Например, для белой крысы незаменимыми являются 10 аминокислот, а для молочнокислых бактерий — 16. Растения могут самостоятельно синтезировать самые разнообразные аминокислоты, создавать такие, которые не встречаются в белках.
Для удобства 20 главных аминокислот обозначают символами, используя одну или первые три буквы русского или английского названия аминокислоты, например аланин — Ала или А, глицин — Гли или G.
Некоторые формулы аминокислот:
NH2 – CH – COOH
|
CH – CH3 - валин
|
CH3
H3C – CH – CH2 – CH – COOH - лейцин
| |
CH3 NH2
NH2 – (CH2)4 – CH – COOH - лизин
|
NH2
NH2 – CH – COOH - серин
|
CH2OH
HS – CH2 – CH – COOH - цистеин
|
NH2
«ИМЕНА» АМИНОКИСЛОТ
Аминокислоты, как правило, имеют исторические названия — по источнику, из которого они впервые были выделены. Например, аспарагин обнаружили в 1806 г. в соке аспарагуса (спаржи), а глутаминовую (от лат. gluten — «клей») кислоту — в клейковине пшеницы. Цистеин (от греч. «цистис» — «пузырь») был впервые выделен в 1810 г. из камней мочевого пузыря. При изучении молочного белка казеина был открыт тирозин (от греч. «тирос» — «сыр»). Аргинин (от лат. argentum — «серебро») был впервые получен в виде соли серебра. Глицин назван так за сладкий вкус (от греч. «гликис» — «сладкий»). Название «лейцин» произошло от греческого слова «лейкос» — «белый»: в яичном белке это одна из самых распространённых аминокислот. Лизин получил своё название от одного из значений греческого слова «лизис» — «растворение», «разрушение», благодаря очень хорошей растворимости в воде. Некоторые аминокислоты были получены из белков шёлкового волокна, например гистидин (от греч. «гистос» — «ткань») и серии (от лат. sericus— «шёлковый»).
Схема образования аминокислот:
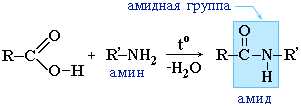
ЧТО ТАКОЕ ПЕПТИД 
Полимерная молекула белка образуется при соединении в длинную цепочку бусинок-аминокислот. Они нанизываются на нить химических связей благодаря имеющимся у всех аминокислот амино- и карбоксильной группам, присоединённым к a-атому углерода.
Образующиеся в результате такой реакции соединения называются пептидами; (—СО—NH—)-группировка в них — это пептидная группа, а связь между атомами углерода и азота — пептидная связь (её ещё называют амидной). Соединяя аминокислоты посредством пептидных связей, можно получить пептиды, состоящие из остатков очень многих аминокислот. Такие соединения получили название полипептиды. Полипептидное строение белковой молекулы доказал в 1902 г. немецкий химик Эмиль Герман Фишер.
На концах аминокислотной цепочки находятся свободные амино- и карбоксильная группы; эти концы цепочки называют N- и С-концами, Аминокислотные остатки в Эмиль Герман Фишер олипептидной цепочке принято нумеровать с N-конца.

Общее число аминокислотных остатков в белковой молекуле изменяется в очень широких пределах. Так, человеческий инсулин состоит из 51 аминокислотного остатка, а лизоцим молока кормящей матери — из 130. В гемоглобине человека 4 аминокислотные цепочки, каждая из которых построена из примерно 140 аминокислот. Существуют белки, имеющие почти 3 тыс. аминокислотных остатков в единой цепи.
Молекулярные массы белков лежат в диапазоне примерно от 11 тыс. для малых белков, состоящих из 100 аминокислотных остатков, до 1 млн. и более для белков с очень длинными полипептидными цепями или для белков, состоящих из нескольких полипептидных цепей.
Фрагмент структуры белка:

Классификация белков:
1. По составу:
1.1 простые (протеины) – состоят только из аминокислот (например, глютеины – белок злаковых);
1.2 сложные (протеиды) – кроме аминокислотных остатков содержат дополнительные компоненты (например, металлопротеиды, фосфопротеиды, липопротеиды и т.д.)
2. По форме белковых молекул:
2.1 фибриллярные – от лат. fibra – «волокно» - (простые) – длинные волокна – нерастворимы в воде, механически прочные (например, коллаген: сухожилия, связки; кератин: волосы, ногти, перья, фиброин: шёлк, паутина);
2.2 глобулярные
3. По раствормости:
3.1 растворимые (альбумины) – растворимость определяется наличием заряженных и полярных группировок (СОО-, NН3+, ОН-), которые притягивают к себе молекулы воды, формируя гидратную оболочку;
3.2 нерастворимые – фибриллярные: кератин, коллаген, фиброин.
4. По выполняемым фукциям:
4.1 структурные
4.2 питательные
4.3 сократительные
4.4 транспортные
4.5 каталитические
4.6 защитные и т.д.
Электрические свойства белков:
определяютя присутствием на их поверхности «+» и «-» заряженных аминокислотных остатков.
Если в белке преобладают «-» заряженные аминокислотные остатки, то молекула белка заряжена отрицательно, если же – «+», то положительно заряжена.
Заряд белка зависист от рН среды:
1. рН > 7, т.е. среда щелочная:
R – COO- + H+ → R – COOH
R – NH2 + H+ → R – NH3+
2. pH < 7, т.е. среда кислотная
R – COOH + OH- → R – COO- + H2O
R – NH3+ + OH- → R – NH2 + H2O
Значение рН, при котором суммарный заряд белка равен 0, называется изоэлектрической точкой.
В изоэлектрическом состоянии растворимость белка минимальна.
Дата добавления: 2015-10-16; просмотров: 135 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| АМИНОКИСЛОТЫ | | | Структура белка |