
|
Читайте также: |
На стадии металл-аффинной хроматографии по хроматограмме определяли, что исследуемый белок pkb 5 содержится в фракциях 31 и 32.
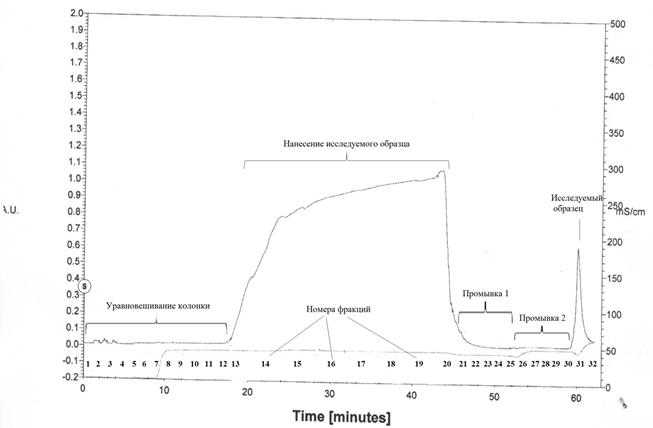 Рис..Хроматограмма выделения каталитического домена pkb 5
Рис..Хроматограмма выделения каталитического домена pkb 5
Далее определяли количества исследуемого образца по методу Брэдфорд и рассчитывали концентрацию pkb 5 (таблица).
| № пробы | Оптическая плотность | Количество в 5 мкл, мкг | Концентрация, мкг/мкл |
| 0,758 | |||
| 0,513 | 1,8 |
Фракции 31 и 32 объединяли, так как в них содержиться исследуемый белок.
Так как каталитический домен pkb5 выделялся в денатурирующих условиях, для дальнейшего исследования было необходимо провести рефолдинг этого белка.
На следующем этапе объедененные фракции диализовали для рефолдинга pkb5 из денатурирующих условий в нативные условия.
На следующей стадии для проверки оптимальных условий хроматографической очистки pkb5 различных фракций, провели электрофоретическое разделение белков в денатурирующем SDS- полиакриламидном геле.

Рис. Электрофореграмма полученная в результате очистки pkb5; а) 1- лизат, 2- фракции 13-20, 3- фракции 26-27, 4- фракция 31, 5- исследуемый образец после диализа, 6- маркерные белки (Prestained Protein Molecular Weight Marker, 20-120 kDa); б) 1- лизат, 2- фракции 13-20, 3- фракции 26-27, 4- фракция 31, 5- маркерные белки (Prestained Protein Marker, Broad Range, 7-175 kDa), 6- исследуемый образец после диализа
В таблице (..) указано конечное количество белков наносимое на электрофорез.
Таблица(..)
| № пробы | Лизат | Фракции 13-20 | Фракции 26-27 | Фракция 31 | Исследуемый образец после диализа |
| Количество, мкг |
На следующем этапе после ступенчатого диализа увеличивали концентрацию исследуемого белка pkb 5 для дальнейшего измерения активности.
Ранее была проведена проверка фосфотрансферазной активности каталитического домена pkb5. Сотрудниками лаборатории генетики микроорганизмов с.н.с., к.т.н. Мавлетовой Д. А. и м.н.с. Мирончевой Т. А. ИОГен им. Н. И. Вавилова Ран было проведено автофосфорилирование каталитического домена pkb5 с использованием [γ-32P]-ATP (рис).
а)  б)
б) 
Рис. а) Электрофореграмма автофосфорилирования pkb5. б) Авторадиограмма автофосфорилирования pkb5
Проверка активности
Реагент Kinase-Glo использует остаточное количество АТФ как субстрат для Ultra-GloTMLuciferase, катализируя монооксигенацию люциферина, с образованием фотона света (рис. 1). Активность протеинкиназы обратно пропорциональна интенсивности сигнала люминесценции. 
Рис. 1. Схема реакции Kinase-Glo® Assey
По люминесцентным данным построен график зависимости процента автофосфорилирования от количества протеинкиназы pkb 5 (рис.).

Рис. Процент автофосфорилирования pkb 5
Дата добавления: 2015-10-21; просмотров: 62 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Штаммы и среды. | | | Национальное вино и шампанское |