
Читайте также:
|
В конце 19 и начале 20 века было установлено, что атом состоит из ядра и движущихся вокруг него электронов. Размер атомов порядка 10-9-10-10 м, а размеры ядра @ 10-15 м. То есть большая часть массы всего атома (>99,95%) сосредоточена в ядре. В обычном состоянии атомы электрически нейтральны, по крайне мере на расстояниях значительно превышающих их размеры, а это возможно лишь в том случае, если в состав атома входят другие частицы положительно заряженные, которые компенсируют отрицательный заряд электронов. В 1911 г. английский физик Э.Резерфорд, на основе выполненных экспериментов, предложил именно такую ядерную (планетарную) модель атома.
В соответствии с моделью атома Резерфорда электроны должны вращаться вокруг ядра, то есть двигаться с ускорением, но согласно законам классической электродинамики, они должны непрерывно излучать электромагнитные волны и, следовательно, терять энергию. Постепенно электрон должен был бы приближаться к ядру, частота его излучения должна была бы изменяться непрерывно, то есть спектр излучения должен был бы быть непрерывным а атом неустойчивым соединением. Однако атомы устойчивы и их излучение имеет линейчатый спектр, причем каждому атому соответствует вполне определенный, характерный только для него спектр, Это было установлено в результате многочисленных экспериментов, а также была определена одинаковость линейчатых спектров излучения и поглощения отдельных атомов, что позволило сделать вывод о парциальных количествах энергии (квантах), излучаемой или поглощаемой.
Отсюда следует, что атом может находиться только лишь в определенных (дискретных) энергетических состояниях. Исходя из таких предположений датский физик Н. Бор в 1913 году на основе модели атома Резерфорда предложил более совершенные представления о строении атома, сформулировав их в виде постулатов (постулаты Боры):
1. Электроны могут двигаться в атоме только по строго определенным орбитам, радиусы которых определяются условием квантования
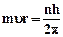 ,
,
где m = 9,11·10-31 кг – масса электрона, υ – скорость его движения по орбите радиуса r, n - квантовое число (n= 1, 2, 3…), h = 6,63·10-34 Дж.с – постоянная Планка
2. Переход электрона с одной стационарной орбиты на другую сопровождается либо излучением (переход с более удаленной на менее удаленную), либо поглощением кванта энергии.
Энергия кванта поглощенного или излученного равна разности энергий атома, соответствующих его стационарным состояниям до и после излучения (поглощения)
 .
.
Таким образом, частота электромагнитных волн, излучаемых атомом, определяется не частотой вращения электронов в атоме (по Резефорду), а разностью энергий стационарных состояний атома.
Дата добавления: 2015-10-13; просмотров: 148 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гипотеза де Бройля | | | Энергетические уровни атомов |