
Читайте также:
|
V, мл КMnO4 КMnO4 моль [Mn2+]моль [Fe2+] моль [Fe3+] моль [Fe3+] /[Fe2+] Е,В
50 0,05 0,05 0,05 1 0,77
90 0,09 0,01 0,09 10 0,83
99 0,099 0,001 0,099 100 0,89
99,9 0,0999 0.0001 0,0999 1000 0,95
100 0,1 MnO4/ Mn2+ 1,387
100,1 0,0001 0,1 1000 1,475
101 0,001 0,1 100 1,486
110 0,01 0,1 10 1,498

Итак, к 100 мл раствора соли двух валентного железа (сульфата) прибавили 50 мл раствора КMnO4 той же нормальности. При этом 50% исходных ионов Fe2+ превратились в ионы Fe3+.
ЕFe3+/Fe2+=0,77+0,059/1 х lg 0,05/0,05=0,77в.
В точке начала скачка титрования потенциал системы будет равен:
ЕFe3+/Fe2+=0,77+0,059/1 x lg 0,0999/0,0001= 0,77+0,059×4=0,95 в.
Вычислим теперь значение потенциала раствора в точке эквивалентности.
MnO4 - + 8H+ + 5Fe2+ ® 5Fe3+ + 4H2O + Mn2+
Здесь пригодилось бы знание константы равновесия этой реакции.
 ; т.о. К=1062
; т.о. К=1062
Очень большое значение К говорит о полноте осуществления реакции, т.е. в Т.Э. практически отсутствуют ионы MnO4 - и Fe2+ и рассчитать потенциал по уравнению Нернста опять невозможно.
Примем, что в Т.Э. потенциал смеси в общем виде можно рассчитать Е= 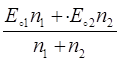
Если концентрацию протонов принять за 1, уравнение принимает вид: Е=  =1,387в
=1,387в
Конец скачка титрования может определяться по формуле для нахождения потенциала системы
MnO4-/Mn2+: Е MnO4-/Mn2+ =1,51+  . При дальнейшем добавлении титранта соотношение концентраций солей железа практически не изменяется, но в систему вводятся новые порции перманганата, при неизменном количестве марганца (II), поэтому можно рассчитать соотношение ионов MnO4/ Mn2+
. При дальнейшем добавлении титранта соотношение концентраций солей железа практически не изменяется, но в систему вводятся новые порции перманганата, при неизменном количестве марганца (II), поэтому можно рассчитать соотношение ионов MnO4/ Mn2+
Е MnO4-/Mn2+ =1,51+0,059/5 х lg 1000=1,51- 0,059 х 3/5 =1,475в.
Анализ кривой титрования показывает, что характер изменения потенциала системы (раствора) аналогичный кривым титрования метода нейтрализации, т.е. имеется скачок титрования. Потенциал раствора изменяется медленно и поэтому обе ветви кривой титрования (до и после скачка)-пологие.
Величина скачка зависит от разности окислительных потенциалов обоих пар: с увеличением этой разности скачок увеличивается. Точка эквивалентности (потенциал ее) не приходится на середину скачка титрования. Кривые оксидиметрического титрования не зависят от разбавления раствора, если отношение концентраций окислительной к восстановительной формы не меняется. (Это преимущественно относится к случаям когда коэффициенты у окислительной и восстановительной форм одинаковы.) Следует делать скидку из положений и на рН которое при разбавлении может изменяться.
Скажем, этих выводов нельзя делать (о исключении влияния разведения на потенциал системы)для такого случая как реакция окисления Fe2+ в Fe3+ действием K2Cr2O7
6Fe2+ + Cr2O72- + 14H+«6Fe3+ + 2Cr3+ +7H2O
Кроме этого (независимость скачка титрования от разбавления) редокститрование позволяет значительно расширить область скачка титрования путем связывания образующихся ионов в малодиссоциируемый комплекс.
Так если для нашего примера (титрование Fe2+ раствором KMnO4) удается уменьшить концентрацию Fe3+ в 10 000 раз путем введения в титруемую систему комплексообразующих веществ (F-,РО43- и др.) то следуя формуле для определения Е системы: [Fe3+]
ЕFe3+/Fe2+=0,77+  4 = 0,712 т,е скачок на кривой титрования расширится и начнется уже не при 0,944, а при 0,712в, а закончится как и прежде при 1,475в.
4 = 0,712 т,е скачок на кривой титрования расширится и начнется уже не при 0,944, а при 0,712в, а закончится как и прежде при 1,475в.
Дата добавления: 2015-08-21; просмотров: 82 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Кривые титрования по методу окисления восстановления | | | Индикаторы методов окисления-восстановления. |