
Читайте также:
|
В соответствии с теми изменениями Е окислительно-восстановительной системы, которые рассмотрены нами на примере кривой титрования Fe2+ раствором KMnO4 самым удобным способом фиксирования точки эквивалентности при редокс-определениях является метод индикаторного титрования, при котором в качестве индикатора будет использоваться вещество, меняющее свою окраску при потенциале системы, входящем в приделы скачка титрования, подобно тому как в случае кислотно-основного титрования применяют индикаторы, изменяющие свою окраску в зависимости от рН среды.
Такие индикаторы есть. Однако большая часть из них имеет свои недостатки. Так в зависимости от рН раствора обычно изменяется значение потенциала при котором наблюдается переход индикатора из одной форм в другую. Иногда изменение окраски происходит очень медленно или образуются другие промежуточные соединения.
С другой стороны, в наиболее распространенных методах −перманганатометрии, иодометрии - индикаторы не применяются, т.к. сам рабочий раствор перманганата интенсивно окрашен, во втором случае хорошо известно применение чувствительного специального индикатора – крахмала.
Т.О. в методах, основанных на изменении валентности реагентов, применяют несколько различных типов индикаторов, подразделить которые можно на группы.
I. Специфические реактивы в качестве индикаторов. В конце титрования с такими индикаторами наблюдается исчезновение или появление окраски, характерное для данного определяемого вещества. Крахмал в иодометрии
II. Рабочие растворы в качестве индикаторов. В конце титрования с такими индикаторами наблюдается исчезновение или появление окраски, характерное для данного рабочего раствора (KMnO4 одновременно и рабочий раствор и индикатор,).
III. Red-ox индикаторы, обратимо изменяющие свою окраску в зависимости от окислительного потенциала раствора. Они обратимо могут окисляться или восстанавливаться, и эти формы индикатора различно окрашены.
| Индикатор | Окраска | E0 при [Н+]=1, в | |
| IndОк. | IndВос. | ||
| Дифениламин | Сине -фиолетовый | Бесцветный | +0.76 |
| Дифениламиназо- сульфоновая кислота | Красно-фиолетовый | Бесцветный | +0.84 |
| Фенилантрани- ловая кислота | Красно-фиолетовый | Бесцветный | +1,08 |
| о-фенантролин-Fe2+-комплекс (ферроин) | Бледно-голубой | Красный | +1,06 |
| о,о′-Дифенила- миндикарбоновая кислота | Сине-фиолетовый | Бесцветный | +1,26 |
IV. Кислотно-основные индикаторы, необратимо изменяющие свою окраску при вступлении в Red-ox реакцию (за счет необратимого окисления и изменения хим структуры – разрушение хромофорных групп).
Наиболее часто применяются обратимые Red-ox индикаторы, для которых превращение одной формы в другую можно изобразить при помощи следующего уравнения: Ind окисл. + n℮ → Ind восст. Очевидно система, состоящая из Ind окисл. и Ind восст. представляет собой окислительно-восстановительную пару, к которой в полнее можно применить формулу Нернста:  ,
,
При титровании раствора соотношение  будет изменяться. Применяются рассуждения аналогично кислотно-основным индикаторам, что присутствие одной из различно окрашенных форм глаз перестает замечать когда концентрация ее становиться в 10 раз меньше, чем концентрация другой формы.
будет изменяться. Применяются рассуждения аналогично кислотно-основным индикаторам, что присутствие одной из различно окрашенных форм глаз перестает замечать когда концентрация ее становиться в 10 раз меньше, чем концентрация другой формы.
Для области перехода окраски окислительно-восстановительного индикатора получим следующие пределы потенциала Е:
если отношение окисленной и восстановленной форм =10  ,
,
если = 0,1 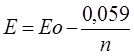 , а точка конца титрования = Е
, а точка конца титрования = Е
Т.О. имея расчетную кривую титрования можно подобрать индикатор, ox|red потенциал которого попадает внутрь скачка титрования.
 Наиболее известны индикаторы
Наиболее известны индикаторы
– дифениламин -раствор в конц. серной кислоте, одноцветный, интервал перехода окраски Е = 0,76±0,029
Дифениламин при действии окислителей окрашивается в синий цвет. Для приготовления индикатора готовят 1% (весо-объемным путем) раствор дифениламина в концентрированной азотной кислоте. На титрование берут одну каплю раствора индикатора.
Если к исследуемому раствору перед титрованием перманганатом прибавить дифениламин, то в тот момент, когда реакция между перманганатом и определяемым веществом закончится и в растворе окажется не значительный избыток перманганата (доля капли), появляется синее окрашивание раствора.
Так дифениламин под действием окислителей с достаточно высоким окислительным потенциалом, на пример KMnO4, K2Cr2O7, KClO3, KNO3 и т.п. превращается сначала в бесцветное соединение-дифенилбензидин который также применяется в качестве индикатора. Затем дифенилбензидин окисляется, образуя дифенилбензидин фиолетовый (III) (интенсивное фиолетово-синее окрашивание)
В случае дифениламина, Ео= +0,76в, а n=2, область перехода лежит в пределах от Е1=0,76 -  (бесцв.) до Е2=0,76 +
(бесцв.) до Е2=0,76 +  (сине-фиолетовое)
(сине-фиолетовое)
- ферроин комплекс фенантролина и железа 3+,растворим в воде, Е = 1,06 В двуцветный индикатор, устойчив в растворах при нагревании.
Индиго при действии некоторых окислителей синяя окраска обесцвечивается, превращаясь в изатин. Таким образом, при применении этого индикатора в момент окончания реакции происходит исчезновение синей окраски исследуемого раствора. Индикатор готовится (0,2% раствор) на концентрированной серной кислоте. При титровании берут одну каплю раствора индикатора.
Индикаторы подобного типа изменяют свою окраску не от специфических свойств окислителя или восстановителя, реагирующих между собой при титровании, а связано изменение окраски с достижением титруемым раствором определенного окислительного потенциала.
Дата добавления: 2015-08-21; просмотров: 137 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Введено теоретически практически в растворе | | | Лауреат III степени |