
Читайте также:
|
Формула для расчета селективности
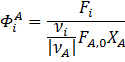
XA = (100–10)/100 = 0,9
ФCH2OCH3OH = 80/(100*0,9) ≈ 0,89
Тема - Вывод кинетических уравнений
Задание - kinet13
Для следующей схемы элементарных стадий:
A <=> X1 + Z1
X1 + Y ® B
B <=> X2 + Z2
X2 + B ® C
Вывести кинетическое уравнение, записать уравнение скоростей превращения по веществам А и C (-dCA/dt и dCC/dt), преобразовать их в концентрационную форму, как функцию только двух переменных (СAи СC), имея в виду, что промежуточные частицы Х образуются в пренебрежимо малой концентрации.
Поскольку концентрация частицы X мала, можно применить принцип Боденштейна-Семенова и приравнять скорость изменения [X] нулю:


откуда получаем выражение для стационарной концентрации X:


Скорости расходования вещества A и образования вещества B равны соответственно:


Теперь запишем суммарные реакции, исключив промежуточное вещество X, количество которого из-за малой концентрации не нужно учитывать в уравнениях материального баланса:
A + Y ® B + Z1 и B + B ® C + Z2
или
A + Y ® B + Z1 и 2A + 2Y ® C + Z2
Из последних двух уравнений суммарных реакций следуют уравнения баланса:





Подставив концентрации в приведенные выше кинетические уравнения, получим искомые уравнения:


Тема - Вывод кинетических уравнений
Задание - kinet45
Для следующей схемы элементарных стадий:
A + K <=> AK
Y + AK ® K + B
AK + B ®C + K
C + K <=> CK
Вывести кинетическое уравнение, записать уравнение скоростей превращения по веществам А и В (-dCA/dt и dCB/dt), преобразовать их в концентрационную форму, как функцию только двух переменных (САи СВ), имея в виду, что CK << Ci,0, равновесие устанавливается быстро и Ci,0 известны.
Катализатор K образует комплексы AK и CK по быстрым обратимым реакциям, что позволяет воспользоваться выражениями для констант равновесия для вычисления их концентраций  и
и  .
.
Общая концентрация катализатора сK не меняется во времени и равна сумме концентраций свободного катализатора [K] и его комплексов с А и C

Из записанных уравнений следует:
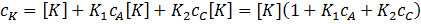
Отсюда:


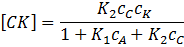
Искомые изменения концентраций вещества A и B описываются уравнениями:


В дифференциальном виде


Для выражения концентрации Y через концентрации A и B запишем уравнения суммарных реакций, исключив концентрации катализатора и его комплексов, как не влияющих на уравнения материального баланса по реагентам ввиду малости концентрации катализатора (сi,0>>сK):
A + Y ® B
2A + Y ® C
Отсюда уравнения материального баланса имеют вид:

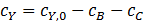

Подставив концентрации в приведенные выше кинетические уравнения, получим искомые уравнения:


Тема - Кинетика и механизм радикальных реакций
Задание - rad08
Вопрос №1
Напишите схему элементарных стадий и выражение для экспериментальной энергии активации реакции инициированного хлором дегидрохлорирования тетрахлорэтана через энергии активации стадий, если экспериментальное кинетическое уравнение имеет вид:
r = k.[Cl2]0.5[Cl2CHCHCl2]
Вопрос №2
Выведите кинетическое уравнение термического бромирования толуола, учитывая, что одна из стадий развития цепи обратима:
PhCH3 + Br. <=> HBr + PhCH2.
Вопрос №3
При длительном хранении на воздухе трет. бутилбромида образуется его изомер - BrСH2СН(СH3)2. напишите элементарные реакции этой изомеризации.
Вопрос №4
Как получить окись пропилена и уксусную кислоту из пропилена, ацетальдегида и воздуха?
Дата добавления: 2015-09-03; просмотров: 85 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Записать уравнения суммарных независимых реакций образования ключевых продуктов | | | Вопрос №1 |